Actualizado a fecha de 15 de mayo de 2018. Bibliografía revisada hasta el 31 de diciembre de 2017. El documento es completamente nuevo.
INTRODUCCIÓN
La audición nos permite procesar e interpretar los sonidos que nos rodean y así sabemos que alguien se acerca cuando oímos unos pasos, nos emocionamos con la música o nos comunicamos a través del lenguaje. El lenguaje es una habilidad compleja que facilita la comunicación y permite compartir pensamientos y sentimientos. El proceso por el que aprendemos y desarrollamos el lenguaje de forma natural es a través de la audición. La hipoacusia en la primera infancia limitará los estímulos auditivos y afectará significativamente al desarrollo del lenguaje y el habla, además de restringir el vínculo con el mundo que nos rodea. El momento de aparición de la pérdida auditiva, el tipo de hipoacusia y el grado de afectación influyen significativamente en las consecuencias que tendrá la sordera en el desarrollo comunicativo y lingüístico.
La mayoría de las hipoacusias neonatales son neurosensoriales (HNS). Al menos el 50-60 % tienen etiología genética y las restantes son adquiridas [1]. Las hereditarias tienen un patrón de herencia autosómica recesiva (p. ej. mutaciones en el gen GJB2) en alrededor del 80 % de los casos, autosómica dominante (p. ej. síndrome de Waardenburg) en el 15 % y el resto son ligadas al cromosoma X o mitocondriales. Las hipoacusias no hereditarias pueden ser debidas a infecciones (citomegalovirus, rubeola, toxoplasma, sífilis, virus del Zika) medicamentos (antipalúdicos, ácido retinoico), toxinas con efecto teratógeno que alteran el desarrollo del oído en el periodo fetal (alcohol, metilmercurio) o condiciones perinatales adversas (asfixia neonatal, prematuridad, hiperbilirrubinemia).
En los lactantes y niños pequeños, la detección y el tratamiento precoces de la hipoacusia puede mejorar los resultados lingüísticos y escolares. La consideración de que el resultado de la intervención es mejor cuando se inicia a edades tempranas parte de la premisa de que hay un periodo crítico o sensible para el desarrollo del lenguaje oral [2], aunque esto es algo controvertido pues en algunos estudios se ha visto un crecimiento acelerado o en catch-up para los niños que reciben tardíamente la amplificación auditiva [3]. La intervención terapéutica en la hipoacusia congénita es multidisciplinar, con participación de otorrinolaringólogos, pediatras, audioprotesistas, logopedas, maestros y otros servicios. La pérdida auditiva puede mejorar con el uso de audífonos desde edades tan tempranas como el primer mes de vida o con implantes cocleares a partir de los 6-12 meses. La intervención logopédica y el apoyo a la familia se inician desde la confirmación diagnóstica.
En ausencia de cribado, la edad media a la que se confirma el diagnóstico de hipoacusia congénita en niños sin factores de riesgo está en torno a los 2-3 años [4–10]. Los que tienen hipoacusias leves o moderadas con frecuencia son identificados después de los 4 años [11,12]. El cribado selectivo de niños con factores de riesgo permite detectar alrededor de un 50 % de niños con hipoacusia congénita, lo que implica que el otro 50 % tendrá un diagnóstico tardío. Por esta razón, y a pesar de que el cribado selectivo es más eficiente, se ha ido abandonando progresivamente a favor del cribado universal.
Los programas de cribado auditivo neonatal universal se han extendido ampliamente a pesar de la falta de pruebas sólidas que avalen su eficacia y coste-efectividad. Su objetivo es la identificación de las hipoacusias poco tiempo después del nacimiento y el inicio del tratamiento tan pronto como sea posible, para lograr mejores resultados a largo plazo a nivel poblacional. El coste de estos programas es elevado y las revisiones sistemáticas han encontrado escasa evidencia de buena calidad sobre su eficacia y efectividad [13–16]. Diversos estudios realizados en la década de 1990, que ligaban el diagnóstico y tratamiento tempranos con mejores resultados en el lenguaje [17–19], desencadenaron el despliegue a gran escala del cribado universal a pesar de tener limitaciones metodológicas importantes [20]. Sin embargo, dada la extensión y aceptación actual de los programas de cribado auditivo neonatal, la puesta en marcha de ensayos aleatorizados es altamente improbable.
DEFINICIONES
El defecto de audición o hipoacusia es la incapacidad para oír tan bien como lo hacen las personas con audición normal, cuyo umbral auditivo en ambos oídos es de 0 a 25 decibelios (dB). La hipoacusia es un continuo que va desde la pérdida leve hasta a pérdida total de la audición o sordera.
El anexo II contiene un glosario de términos utilizados en el documento.
Grados de hipoacusia
El grado de pérdida auditiva se define midiendo el umbral auditivo en decibelios a varias frecuencias. La Organización Mundial de la Salud (OMS) clasifica la hipoacusia según el grado de pérdida de decibelios [21]:
- Deficiencia auditiva leve: de 26 a 40 dB.
- Deficiencia auditiva moderada: de 41 a 60 dB.
- Deficiencia auditiva grave: de 61 a 80 dB.
- Deficiencia auditiva profunda: 81 dB o más.
La Oficina Internacional de Audiofonología (BIAP) establece la siguiente clasificación atendiendo a la pérdida en decibelios y a la relación entre audición y lenguaje [22]:
- Deficiencia auditiva leve: de 21 a 40 dB. Se percibe el habla si la voz es normal, pero hay dificultades para oír la voz baja o distante. Se perciben la mayoría de los ruidos familiares.
- Deficiencia auditiva moderada: 41 a 70 dB. Es necesario elevar la intensidad de la voz para percibir las palabras. El sujeto entiende mejor cuando mira al interlocutor. Se perciben algunos sonidos familiares.
- Deficiencia auditiva grave: 71 a 90 dB. Solo se percibe la voz fuerte cerca del oído y los ruidos fuertes.
- Deficiencia auditiva profunda: 91 a 119 dB. No se percibe el habla, solo se oyen los ruidos muy fuertes.
- Cofosis: por encima de120 dB. Pérdida total de audición, no se oye nada. Son sorderas muy excepcionales.
Las hipoacusias moderadas o de grado superior cursan con dificultad para oír la voz normal, lo que genera problemas para la adquisición del lenguaje. La OMS define la pérdida de audición discapacitante como la pérdida auditiva superior a 40 dB en el mejor oído en adultos y superior a 30 dB en el mejor oído en niños. El cribado auditivo neonatal busca detectar las hipoacusias de moderadas a profundas porque no está claro el impacto de las hipoacusias leves. Grados leves de hipoacusia en la etapa escolar pueden afectar a la adquisición del lenguaje y al rendimiento escolar, pero disponemos de poca información sobre la frecuencia y significado de la hipoacusia leve en el periodo neonatal.
MAGNITUD DEL PROBLEMA
Prevalencia
La mayoría de las hipoacusias infantiles se manifiestan en el primer año de vida y el 80% están presentes en el momento de nacer. La incidencia de hipoacusia bilateral de moderada a profunda en la población neonatal es de 1 a 2 por cada 1000 nacidos [23–30]. Si se incluyen las hipoacusias leves y las que son unilaterales, la cifra aumenta al 3-5 por 1000. En España disponemos de pocos datos. Un estudio multicéntrico publicado en 1994, en el que se hizo cribado auditivo a una muestra de 501 recién nacidos con factores de riesgo de hipoacusia, seleccionados de una población de 12.839 recién nacidos, encontró una prevalencia de hipoacusia bilateral superior a 30 dB de 2,02 por 1000 nacidos, y de 0,77 por 1000 nacidos para las hipoacusias bilaterales superiores a 60 dB [31]. Los niños sin factores de riesgo no fueron estudiados, por lo que la prevalencia real está subestimada. En Cantabria, los resultados de los dos primeros años del programa de cribado auditivo arrojaron una tasa de incidencia de 1,38 por 1000 nacidos (25,6/1000 para los que tienen factores de riesgo y 0,5/1000 para el grupo sin riesgo) [32].
En recién nacidos con factores de riesgo (tabla 1), la incidencia de hipoacusia neurosensorial de moderada a profunda es de 10 a 20 veces mayor que en la población general [20,32,33]. El porcentaje de recién nacidos con factores de riesgo en los países desarrollados es del 5-10% [33,34]. El cribado selectivo de los niños con factores de riesgo permite identificar al 45-60% de las hipoacusias neurosensoriales de grado moderado a profundo [11,23,26,35–38].
Tabla 1. Factores de riesgo de hipoacusia [39–41]
| Factores de riesgo de hipoacusia permanente |
| Historia familiar de hipoacusia |
| Infecciones perinatales: CMV, toxoplasmosis, rubeola, VIH, virus del Zika |
| Exposición prenatal a antipalúdicos, ácido retinoico, aminoglucósidos, diuréticos de asa, cisplatino |
| Anomalías craneofaciales, incluidos apéndices y fositas preauriculares |
| Síndromes asociados con hipoacusia, incluido el síndrome alcohólico-fetal |
| Enfermedades neurodegenerativas |
| Estancia en UCIN >5 días |
| Asfixia perinatal y especialmente test de Apgar <4 al minuto o <6 a los 5 minutos |
| Hiperbilirrubinemia grave |
| Ventilación mecánica durante >5 días o ventilación con ECMO |
| Peso al nacimiento <1500 g |
| Fármacos ototóxicos (aminoglucósidos o diuréticos de asa) |
| Meningitis |
Abreviaturas: CMV: citomegalovirus. ECMO: oxigenación por membrana extracorpórea. UCIN: unidad de cuidados intensivos neonatales. VIH: virus de la inmunodeficiencia humana.
Aproximadamente el 11 % de los niños que finalmente tienen hipoacusia pasan el cribado auditivo neonatal. De ellos, se estima que el 25 % tenía hipoacusia al nacimiento (verdaderos falsos negativos del cribado), el 50 % son hipoacusias de comienzo tardío y el 25 % restante son adquiridas, principalmente secundarias a una meningitis [42].
Impacto
El sistema auditivo es inmaduro en el recién nacido y se desarrolla a lo largo de la infancia. La cóclea del neonato responde de manera similar a la de un adulto, pero no así la corteza cerebral. Durante el proceso madurativo, el lactante con audición normal aprende a distinguir los sonidos y su significado, aunque le lleva mucho tiempo aprender a conocer todos los detalles de sonidos complejos como el habla. La experiencia con el sonido es crítica para el desarrollo auditivo. Sin embargo, se conoce muy poco el desarrollo auditivo en niños con hipoacusia.
La hipoacusia bilateral implica una limitación en la capacidad para comunicarse con los demás, y cuando aparece en la etapa prelocutiva se asocia a dificultades en el desarrollo del habla y el lenguaje que pueden afectar al desarrollo cognitivo, emocional y psicosocial y tener consecuencias permanentes en el nivel educativo y en las oportunidades de empleo en la edad adulta [11,20,43]. Los niños con hipoacusia tienen dificultades para el aprendizaje del vocabulario, la gramática, el orden de las palabras, las expresiones idiomáticas y otros aspectos de la comunicación verbal [13,44,45].
El desarrollo del lenguaje dependerá del nivel y tipo de deficiencia auditiva y del momento de inicio de la pérdida:
- Hipoacusia leve: aparecen dislalias y retraso general del lenguaje.
- Hipoacusia moderada: aparecen errores fonológicos y articulatorios. Pueden percibir mal las consonantes.
- Hipoacusia grave: es prácticamente imposible adquirir el lenguaje oral de manera espontánea.
- Hipoacusia profunda: se debe recurrir a la percepción vibrotáctil.
La comprensión lectora es dependiente de la capacidad de lenguaje subyacente y se relaciona con los resultados educativos y de empleo. En individuos con hipoacusia bilateral >40 dB, la edad de lectura a los 17 años es equivalente a la de los niños de 9 años con audición normal [15]. En España, un estudio de niños con hipoacusia profunda (>90 dB) de las Islas Canarias, escolarizados durante el curso escolar 2002-2003 (n = 93), mostró que, al final de la educación primaria (edad media de 13 años), el nivel de lectura es equivalente al de los niños de 7 años [46]. También se afecta la escritura: los niños con déficit auditivo utilizan un lenguaje más concreto en sus escritos y tienden a utilizar menos pronombres, preposiciones y adverbios, con frases más cortas y sencillas.
El lenguaje permite estructurar el pensamiento y los niños sordos tienen, en general, un pensamiento más concreto, menos abstracto e hipotético [47]. Son menos eficaces cuando se precisa un nivel alto de procesamiento de la información y tienen un retraso en el desarrollo del pensamiento lógico. También ven limitada la memoria a corto plazo o memoria de trabajo.
No obstante, es difícil establecer la contribución de otras variables: entre el 20 % y el 40 % de los niños con hipoacusia tienen diversas discapacidades asociadas [48], como retraso mental o secuelas de la prematuridad, que pueden contribuir al retraso en la adquisición del lenguaje. El grado de implicación de los padres, la gravedad de la hipoacusia o el tipo de intervención educativa también pueden contribuir a los resultados en cuanto a adquisición del lenguaje y son variables que con frecuencia no han sido tenidas en cuenta en los estudios.
HISTORIA NATURAL
La historia natural de la hipoacusia congénita en niños sin factores de riesgo, que son el objetivo primario del cribado universal, no ha sido estudiada en detalle. Estos niños pueden tener menos discapacidades asociadas que los sordos en general. No se conoce la frecuencia, gravedad o la duración del retraso del lenguaje a lo largo de la infancia y en la vida adulta de este grupo.
MARCO ANALÍTICO Y PREGUNTAS ESTRUCTURADAS
Como se ha indicado en la introducción, en ausencia de cribado auditivo neonatal el diagnóstico de la hipoacusia se retrasa con frecuencia hasta después del año o los dos años de vida y el cribado selectivo a los individuos con factores de riesgo solo detecta a la mitad de los casos aproximadamente.
Para conocer los posibles beneficios y los riesgos del cribado se han elaborado cinco preguntas estructuradas siguiendo el marco analítico del US Preventive Services Task Force (USPSTF), representado en la figura 1. El cribado auditivo neonatal universal será beneficioso si da lugar a un mejor desarrollo del lenguaje en la infancia y, a largo plazo, una mejoría en la función cognitiva, psicosocial y laboral del individuo a lo largo de su vida (flecha 1). Para saber si el cribado produce efectos directos a medio y largo plazo es necesaria la existencia de ensayos clínicos que comparen el cribado universal frente al cribado por factores de riesgo o la ausencia de cribado.
Si no hay pruebas directas sobre los beneficios del cribado, será necesario conocer si los programas de cribado son capaces de detectar de forma fiable los casos de hipoacusia congénita y adelantar la edad de diagnóstico (flecha 2), así como determinar los beneficios del adelanto de la intervención terapéutica (flecha 3). Para establecer el balance entre los beneficios y los riesgos, es preciso determinar los riesgos del cribado (flecha 4) y los efectos secundarios del tratamiento (flecha 5).
Figura 1. Marco analítico para la elaboración de preguntas. Adaptado del USPSTF, con autorización [49].
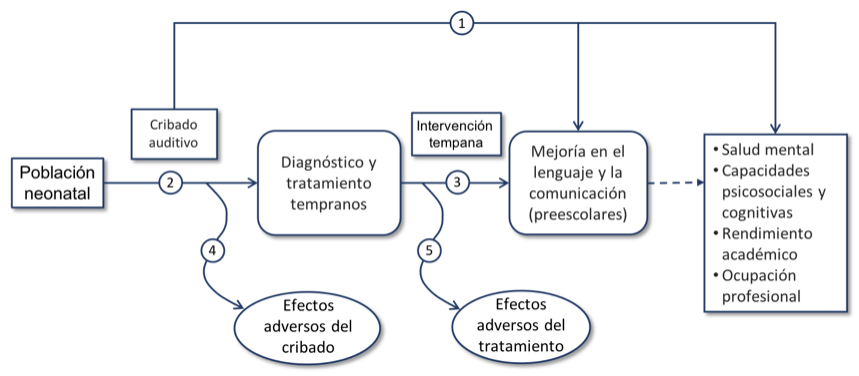
Por último, se analizan en las preguntas estructuradas dos cuestiones que no están incluidas en el marco analítico del USPSTF, pero son de interés para elaborar recomendaciones sobre el cribado auditivo neonatal universal. Una analiza la efectividad y el coste-efectividad de los programas de cribado universal y otra trata de determinar cuál es la estrategia de cribado más efectiva.
PREGUNTAS ESTRUCTURADAS
1. El cribado auditivo neonatal universal ¿se asocia a una mejoría en el lenguaje y la comunicación en preescolares o a mejores resultados de salud?
No hay ensayos aleatorizados que hayan comparado la efectividad del cribado universal con el cribado en grupos de riesgo o el cribado oportunista.
Un estudio retrospectivo de cohortes de base comunitaria, de buena calidad, evaluó el efecto del cribado universal en los resultados del habla y el lenguaje en niños con hipoacusia permanente (Kennedy, 2006) [28]. Fueron incluidos 120 niños (el 71 % de los 168 identificados) con hipoacusia ≥40 dB, procedentes de una cohorte de 157 000 niños nacidos entre 1992 y 1997 en distintas áreas del sur de Inglaterra. De los 120 niños analizados, 61 habían nacido en periodos o en áreas donde se hacía cribado universal y 59 en periodos o en áreas sin cribado. La evaluación del habla y el lenguaje se hizo a los 8 años (edad media de 7,9 años, rango de 5,4 a 11,7). Los nacidos en periodos de cribado universal tuvieron mejores resultados en el lenguaje receptivo (diferencia media en las puntuaciones z de 0,56; IC 95 %, 0,03-1,08; valor de p = 0,03), pero no en el lenguaje expresivo ni en la escala del habla.
Sin embargo, el seguimiento longitudinal de esta cohorte hasta la adolescencia no encontró asociación entre el nacimiento en periodos de cribado universal y mejoras en el lenguaje (Pimperton, 2017) [50]. De los 120 individuos incluidos en el estudio previo sobre los beneficios en el lenguaje [28], 76 aceptaron ser evaluados de nuevo en la adolescencia (edad media de 17 años, rango de 13 a 19) y 60 completaron la valoración del lenguaje, que son los incluidos en el estudio (50 % de los elegibles) [50]. Los que no completaron la evaluación usaban el idioma de signos como forma preferida de comunicación o tenían discapacidades graves asociadas que impedían la evaluación del lenguaje. Los resultados fueron comparados con un grupo de 63 adolescentes con audición normal. Los que habían nacido en periodos de cribado no tuvieron mejores resultados en las puntuaciones z de lenguaje expresivo (diferencia media ajustada de 0,40; IC 95 %, -0,26 a 1,05; valor de p = 0,32), de lenguaje receptivo (diferencia media ajustada de 0,68; IC 95 %, -0,56 a 1,93; valor de p = 0,28) ni en la longitud media de las frases (diferencia media ajustada de 0,45; IC 95 %, -0,08 a 0,98; valor de p = 0,43). El tamaño del efecto para las tres variables fue pequeño en la dirección de favorecer el cribado (d de Cohen para el lenguaje receptivo = 0,28, para el lenguaje expresivo = 0,32 y para la longitud media de las frases = 0,43).
Los resultados en lectura y habilidades de comunicación del mismo grupo de 120 niños han sido publicados en dos estudios [51,52], a una edad media de 8 y 17 años respectivamente. En el primero se evaluó la lectura por medida directa y la comunicación por encuesta a los padres en los 120 niños con hipoacusia y a un grupo de 63 con audición normal [51]. Los que nacieron en periodos de cribado tuvieron a los 8 años mejores resultados en las puntuaciones z de comprensión lectora (diferencia media ajustada de 0,39; IC 95 %, 0,02 a 0,76; valor de p = 0,042) y de la escala de comunicación (diferencia media ajustada de 0,51; IC 95 %, 0,06 a 0,95; valor de p = 0,026) [51]. Estos resultados representan ganancias funcionales importantes. Pero en la adolescencia esta diferencia desaparece nuevamente. En el segundo estudio, un total de 76 de los 120 individuos con hipoacusia y 38 con audición normal fueron evaluados por los investigadores mediante una prueba estandarizada de lectura que evalúa la comprensión y la precisión lectoras, así como la capacidad para hacer un resumen de la lectura [52]. Los nacidos en periodos de cribado tuvieron a los 17 años unos resultados similares a los nacidos en periodos de no cribado tanto en las puntuaciones z de comprensión lectora (diferencia media ajustada de 0,15; IC 95 %, −0,75 a 1,06; valor de p = 0,73) como en la precisión lectora (diferencia media ajustada de 0,09; IC 95 %, −0,76 a 0,93; valor de p = 0,84) y el resumen de la lectura (diferencia media ajustada de 0,22; IC 95 %, −0,58 a 1,03; valor de p = 0,58).
La revisión realizada en 2008 para el USPSTF [13] enumera algunas limitaciones del estudio de Kennedy, que son aplicables también a los publicados posteriormente por el mismo grupo: una posible infraestimación del tamaño del beneficio, puesto que los sistemas de cribado y seguimiento han mejorado desde el inicio del estudio y tras la modernización de los servicios audiológicos; no está claro si en los niños no sometidos a cribado la hipoacusia estaba presente en el momento del nacimiento, y un análisis de sensibilidad indicó que el beneficio para el grupo de cribado hubiera sido mayor si todos los casos de hipoacusia hubieran sido congénitos; el habla no se evaluó con medidas directas sino mediante informes de padres o profesionales, lo que puede disminuir la sensibilidad como medida de resultado. Por otra parte, el seguimiento de la cohorte entre la edad escolar (edad media de 8 años) [28,51] y la adolescencia (17 años de edad media) [50,52] tuvo una tasa elevada de abandonos en los 9 años de intervalo. Este hecho, añadido a una alta variabilidad intragrupo, limita la potencia de los resultados.
Un estudio de calidad moderada, de carácter poblacional, basado en un experimento natural durante el periodo en que se pasó de realizar el test de distracción (respuesta a los sonidos) a los 9 meses a incluir el cribado universal en los Países Bajos (Korver, 2010) [29], comparó el efecto del cribado neonatal universal frente al test de distracción en el desarrollo, la comunicación oral y la calidad de vida. De todos los niños nacidos entre 2003 y 2005, 335 560 nacieron en una región con cribado universal neonatal y 234 826 lo hicieron en una región en la que se aplicaba el test de distracción. Los investigadores identificaron a todos los niños de 3 a 5 años con hipoacusia permanente ≥40 dB (n = 434), de los que resultaron excluidos 133. Los 301 elegibles fueron invitados a participar en el estudio y aceptaron 150 (el 49,8 %), de los que 80 habían nacido en regiones de cribado neonatal y 70 en regiones con test de distracción. El estudio del desarrollo general y del desarrollo del lenguaje se hizo mediante cuestionarios rellenados por los padres.
El análisis de la varianza multifactorial mostró que las puntuaciones globales en el desarrollo fueron significativamente mejores a los 3-5 años en los nacidos en zonas de cribado neonatal (Wilks λ = 0,79; F12 = 2,705; p = 0,003), con diferencias estadísticamente significativas en el desarrollo social (diferencia media entre los grupos de 8,8 puntos; IC 95 %, 0,8 a 16,7) y motor grueso (diferencia media de 9,1; IC 95 %, 1,1 a 17,1), pero con diferencias no significativas en las otras subescalas (desarrollo motor fino, lenguaje receptivo y lenguaje expresivo). El número total de palabras de signos fue estadísticamente menor en el grupo de cribado neonatal (diferencia media entre los grupos de -11,2; IC 95 %, -20,6 a -1,9). El número de palabras habladas fue mayor en el grupo de cribado neonatal, pero la diferencia no fue estadísticamente significativa (diferencia media de 8,7; IC 95 %, -3,9 a 21,2). La complejidad y la longitud de las frases fue similar en ambos grupos. La calidad de vida fue mejor de manera estadísticamente significativa en el grupo de cribado neonatal (diferencia media de 5,3; IC 95 %, 1,7 a 8,9).
Entre las limitaciones del estudio, cabe destacar un posible sesgo de selección dada la posibilidad de que los padres de los niños con menor nivel de desarrollo fueran más reacios a participar; la evaluación de los resultados no se midió directamente sino que fue realizada mediante cuestionarios rellenados por los padres, lo que puede ser causa de un sesgo de información; una verificación del tipo de cribado mostró que 32 niños (el 21,3 % de la muestra de 150) habían sido clasificados de forma errónea: en 12 casos no se había hecho el cribado, 9 habían recibido una evaluación diagnóstica directamente y 10 habían sido incluidos para el análisis en una categoría equivocada (9 con cribado neonatal fueron adjudicados al grupo de cribado con test de distracción y 1 con test de distracción se incluyó en el grupo de cribado neonatal).
Un trabajo de calidad moderada, basado también en un experimento natural de toda la población, comparó los niños con hipoacusia >25 dB nacidos entre 2003 y 2005 en dos estados australianos con demografía y servicios similares, de los que uno (Nueva Gales del Sur) ofrecía cribado auditivo universal, y el otro (Victoria) lo aplicaba solo en niños con factores de riesgo (Wake, 2016) [53]. En el periodo de estudio nacieron 172 523 niños en Nueva Gales de Sur y 123 855 en Victoria. De 313 niños elegibles e invitados a participar, aceptaron 134 (el 42,8 %), 69 de Nueva Gales del Sur y 65 de Victoria, que fueron evaluados a una edad de 5-6 años. También se compararon ambos grupos con la cohorte poblacional de niños con hipoacusia (n = 89) nacidos en Victoria una década antes, entre 1991 y 1993, cuando la detección era oportunista (es decir, sin programas de cribado universal ni por factores de riesgo), evaluados a una edad de 7-8 años.
Para los niños sin discapacidad intelectual asociada, pasar del cribado por factores de riesgo al cribado universal supuso una mejoría significativa en el lenguaje expresivo (diferencia media ajustada de 8,2 puntos; IC 95 %, 0,5-15,9; valor de p = 0,04) y en el vocabulario receptivo (diferencia media ajustada de 8,1 puntos; IC 95 %, 0,8-15,4; valor de p = 0,03). La mejora del lenguaje receptivo no fue estadísticamente significativa (diferencia media ajustada de 5,2 puntos; IC 95 %, -1,9 a 12,3; valor de p = 0,15). Al pasar del cribado oportunista al cribado universal, las diferencias fueron más significativas: 7 puntos (IC 95 %, 0,3-13,8; valor de p = 0,05) para el lenguaje receptivo, 14,4 puntos (IC 95 %, 7,3-21,5; valor de p <0,01) para el lenguaje expresivo y 12,1 puntos (IC 95 %, 5,9-18,4; valor de p <0,01) para el vocabulario receptivo. No obstante, la comparación entre los grupos de cribado universal y cribado oportunista es más difícil de valorar porque habían nacido con una década de diferencia. Las puntuaciones en problemas de comportamiento y en calidad de vida relacionada con la salud fueron similares en todos los grupos.
El diseño del estudio es de buena calidad, aunque la potencia de los resultados está limitada por el elevado número de pacientes que fueron excluidos por rechazo a participar en el estudio o por no estar localizables (57 % de los elegibles). En la medida de lo posible, los investigadores eran ciegos a la gravedad de la hipoacusia y a si realmente se había producido el cribado, pero el diseño basado en la participación por estados impidió el cegamiento al programa de cribado. Otra limitación es la inclusión de niños con hipoacusia leve.
El estudio LOCHI se describe en detalle más adelante (pregunta 3); recientemente se han publicado los datos de seguimiento a los 5 años de 350 niños con hipoacusia permanente, de los que 258 habían recibido cribado auditivo neonatal [54]. No hubo diferencias en la puntuación global del lenguaje entre los que recibieron el cribado frente a los que no lo recibieron, ni en el subgrupo tratado con amplificación auditiva (0,3 puntos; IC 95 %, -4,2 a 4,9; p = 0,88) ni en los que habían recibido implante coclear (6,4 puntos; IC 95 % -2,8 a 16,2; p = 0,19), lo que a juicio de los autores parece atribuible a que no todos los detectados mediante cribado iniciaron el tratamiento precozmente y no todos los que no habían recibido el cribado iniciaron el tratamiento de forma tardía.
El estudio de Colorado (Yoshinaga-Itano, 2000) [18] comparó dos grupos de 25 niños de 9 a 61 meses nacidos en hospitales con cribado universal o en hospitales sin cribado. Los del grupo de cribado tuvieron mejores resultados en cocientes de lenguaje, tanto para el lenguaje global (p <0,001) como para el lenguaje receptivo (p <0,001) y el lenguaje expresivo (p <0,001). Es un trabajo de calidad baja, con una muestra de conveniencia, selección no aleatoria, evaluación no ciega y que no tiene en cuenta posibles variables de confusión.
Un estudio observacional de calidad baja (Fitzpatrick, 2007) [55] incluyó 65 niños menores de 5 años con hipoacusia >20 dB, de los que 26 habían sido identificados mediante cribado (12 a través de cribado universal y 14 mediante cribado selectivo por factores de riesgo) y 29 sin cribado. Un análisis de la varianza de diversas medidas del habla y el lenguaje no encontró diferencias significativas entre los grupos identificados mediante cribado y los identificados por otras vías.
No se ha estudiado adecuadamente el impacto del cribado universal en otros datos relevantes como la calidad de vida, el rendimiento académico, el empleo o la situación social.
2. ¿Cuál es la validez y seguridad de las pruebas de cribado auditivo neonatal? ¿Se consigue con el cribado una identificación y tratamiento tempranos de los niños con hipoacusia congénita?
Las pruebas de cribado más utilizadas son las emisiones otoacústicas (EOA) y los potenciales auditivos evocados automatizados (PAEA) [56–58]. La sensibilidad de estas pruebas es difícil de determinar, porque para conocerla es necesario hacer un seguimiento prolongado de todos los individuos sometidos al cribado que permita definir la tasa de falsos negativos y por la dificultad para comparar las pruebas de cribado con una prueba diagnóstica de referencia. Como es de esperar en enfermedades de baja prevalencia, el valor predictivo positivo es bajo, con un número elevado de falsos positivos. Si asumimos una tasa de derivación del 2 % y una prevalencia del 1-2 ‰, de cada 20 positivos solo uno o dos tendrán hipoacusia y entre 18 y 19 serán falsos positivos.
No hay estudios de cribado universal en recién nacidos con un tamaño de muestra suficiente y un seguimiento de duración suficiente que permitan establecer definitivamente la sensibilidad y la especificidad de cualquiera de esas técnicas. Una revisión sistemática para evaluar los beneficios y los riesgos de los programas de cribado auditivo neonatal universal incluyó 8 estudios transversales que investigaron las EOA comparadas con los PAEA, que en realidad no son una prueba diagnóstica (Wolf, 2010) [14]. En conjunto, la sensibilidad varió entre el 50 % y 100 % y la especificidad entre el 49 % y 97 %. La calidad de los estudios fue baja en general y la heterogeneidad de los resultados impidió hacer un metanálisis. Basados en la revisión de la evidencia, los autores concluyen que no es posible evaluar de manera fiable la precisión diagnóstica de las EOA y los PAEA como pruebas de cribado, ya que no se han evaluado en un grupo suficientemente grande de niños sin factores de riesgo.
Los programas de cribado utilizan muchas veces una estrategia en dos etapas (la segunda se aplica solo a los que no pasan la primera) para disminuir la tasa de derivaciones [5,59–61]. La revisión realizada para el USPSTF en 2008 [13] no actualizó el análisis sobre el rendimiento diagnóstico de las pruebas de cribado porque los autores consideraron que ya había sido adecuadamente valorado con la evidencia existente en la revisión previa, publicada en 2001 [20]. Los tres estudios analizados en la revisión de 2001 se detallan a continuación.
El primero es un ensayo prospectivo cuasi-aleatorizado, durante tres años se alternaron cada 4-6 meses periodos en los que se hacía cribado universal con periodos sin cribado en cuatro maternidades de Wessex, en el Reino Unido [62]. Este ensayo es único porque se crearon de forma experimental dos cohortes de recién nacidos que eran muy similares en todos los aspectos excepto en la exposición al cribado auditivo universal. En los periodos de cribado se realizaron EOA a 21 279 niños (el 83 % de los elegibles), seguidas de PAEA en los que no pasaron la prueba. En los periodos sin cribado nacieron 28 172 niños. La sensibilidad del cribado fue del 92 % (IC 95%: 74 % - 98 %) y la especificidad del 98 % (IC 95%: 98 % - 99 %), con unos cocientes de probabilidades positivo y negativo de 61 y 0,08 respectivamente [63]. En el análisis por intención de cribar (si se incluyen los niños que no participaron en el cribado, que son el 17 %), la sensibilidad sería del 71 % (IC 95%: 52 % - 86 %) [14]. El valor predictivo positivo para la segunda etapa del cribado fue del 6,7 % [62].
El segundo es un estudio realizado en el estado norteamericano de Rhode Island en el que se hizo un análisis retrospectivo de los datos de 53 121 recién nacidos que habían recibido cribado mediante EOA en dos etapas (Vohr, 1998) [27]. El valor predictivo negativo fue del 99,9 % para las dos etapas. La tasa de derivación para estudio audiológico de los niños sin factores de riesgo fue del 1 %; los niños en los que se identificó algún factor de riesgo fueron remitidos directamente para estudio audiológico. La sensibilidad del cribado fue del 95 % para ambas etapas, con una especificidad del 90 % para la primera etapa y del 87 % para la segunda. El valor predictivo positivo pasó del 2 % en la primera etapa al 16 % en la segunda.
El tercero es un estudio financiado por los Institutos Nacionales de la Salud de los Estados Unidos, que comparó el rendimiento de las EOA transitorias (EOAT), las EOA por productos de distorsión (EOAPD) y los PAEA para la identificación de la hipoacusia neonatal (Norton, 2000) [58]. Fueron incluidos un total de 4911 niños, de los que 4478 habían estado ingresados en una unidad de cuidados intensivos neonatales, 353 eran niños sanos con factores de riesgo de hipoacusia y 80 eran niños sanos sin factores de riesgo. En el periodo neonatal fueron evaluados con EOAT, EOADP y PAEA aplicadas en orden aleatorio. Para determinar el rendimiento de estas pruebas, a los 8-12 meses de edad corregida se hizo una audiometría de refuerzo visual a los participantes, aunque por pérdidas en el seguimiento solo se pudo obtener en 2995 niños, y se determinaron las curvas ROC. Las áreas bajo la curva ROC para las tres pruebas realizadas en el periodo neonatal oscilaron entre 0,70 y 0,94 y fueron similares entre ellas para la mayoría de las medidas, lo que indica que todas las pruebas identifican adecuadamente la hipoacusia. La revisión para el USPSTF de 2001 señala que en este estudio las EOA fueron muy sensibles para la hipoacusia profunda (S = 98 %) y menos para las hipoacusias de moderadas a graves (S = 80 %); a esa sensibilidad, la especificidad de la EOA fue del 80 %. Para los PAEA, la sensibilidad fue del 84 % y la especificidad del 90 % [20].
En un estudio del programa de cribado universal en los Países Bajos (Korver, 2013) [64], con 338 525 recién nacidos sometidos al cribado entre 2003 y 2005, la sensibilidad fue del 83 % (79 % para los niños normales que reciben el cribado en tres etapas, dos EOA seguidos de PAEA, y 96 % para los ingresados en unidad de cuidados intensivos neonatales [UCIN], que son cribados con PAEA en dos etapas). La especificidad fue del 99 % para ambos grupos.
Hay buena evidencia de que el cribado neonatal universal da lugar a un adelanto en la edad del diagnóstico y el inicio del tratamiento. En el ensayo de Wessex, el número de casos de hipoacusia derivados fue 19 veces mayor entre los niños que recibieron cribado neonatal frente a los que no lo recibieron [62]. En un estudio de seguimiento hasta la edad de 7-9 años, la proporción de niños identificados antes de los 6 meses fue mayor en periodos de cribado neonatal que en periodos sin cribado neonatal (74 % frente a 31 %) [63].
El estudio de los Países Bajos mostró que, comparado con el test de distracción a los 9 meses, el cribado neonatal universal adelanta la edad de la amplificación auditiva en 13 meses (edad media de 15,7 meses [desviación estándar 14,0] frente a 29,2 meses [desviación estándar 14,4], p <0,001) [29]. En un estudio de base poblacional realizado en Australia, que comparó tres poblaciones sometidas a cribado universal, cribado por factores de riesgo o cribado oportunista, el cribado neonatal universal supuso un adelanto en el diagnóstico de 8 meses (IC 95 % 3,7-12,3; valor de p = 0,002) frente al cribado por factores de riesgo y de 14,4 meses (IC 95 % 9,6-19,3; valor de p = <0,001) frente al cribado oportunista [53].
Estos datos han sido replicados en un número amplio de programas de cribado implementados por todo el mundo [23,30,38,65–69], así como por otros estudios descriptivos [70–73]. Sin embargo, en la práctica habitual estos resultados pueden ser sustancialmente peores si se implementan programas de cribado de mala calidad.
3. El diagnóstico y tratamiento precoz de la hipoacusia congénita ¿permiten un mejor desarrollo del lenguaje y la comunicación?
En niños con hipoacusia, los resultados en el desarrollo del lenguaje y el habla pueden verse influidos por múltiples factores como la edad de diagnóstico e inicio de la intervención, el grado de participación de la familia, el nivel educativo de los padres, el grado de hipoacusia o la presencia de alguna discapacidad asociada. Los estudios que analizan el efecto de la intervención precoz en la hipoacusia congénita para mejorar los resultados en el desarrollo del lenguaje, la lectura o la comunicación son con frecuencia los mismos que han valorado los efectos del cribado y que se han descrito anteriormente, por lo que no se detallan de nuevo.
El estudio de Kennedy [28] proporcionó evidencia de buena calidad de que los niños con confirmación diagnóstica antes de los 9 meses tuvieron a los 8 años resultados moderadamente mejores en el lenguaje receptivo y expresivo pero no en la escala del habla. De los 120 niños estudiados, 57 habían tenido confirmación diagnóstica de la hipoacusia antes de los 9 meses de vida. Con respecto a los de confirmación tardía, el grupo de diagnóstico precoz obtuvo puntuaciones z significativamente mejores para el lenguaje receptivo (diferencia media ajustada de 0,76; IC 95 %, 0,26-1,27; valor de p = 0,004), en el límite de la significación para el lenguaje expresivo (diferencia media ajustada de 0,50; IC 95 %, <0,01-1,01; valor de p =0,05), y sin diferencias significativas para el habla.
Sin embargo, estas diferencias desaparecen en el seguimiento a largo plazo. En la adolescencia (edad media de 17 años), el análisis de 60 de los 120 niños estudiados en la etapa escolar no encontró diferencias estadísticamente significativas en el lenguaje receptivo (diferencia media ajustada de 0,95; IC 95 %, -0,22 a 2,11; valor de p = 0,11), en el lenguaje expresivo (diferencia media ajustada de 0,43; IC 95 %, -0,20 a 1,05; valor de p = 0,18) ni en la longitud media de las frases (diferencia media ajustada de 0,22; IC 95 %, -0,30 a 0,74; valor de p = 0,22) entre los grupos de diagnóstico anterior o posterior a los 9 meses (Pimperton, 2017) [50]. El tamaño del efecto fue pequeño en la dirección de favorecer el diagnóstico temprano para las tres variables (d de Cohen para el lenguaje receptivo = 0,42, para el lenguaje expresivo = 0,35 y para la longitud media de las frases = 0,22).
En cuanto a la lectura, los que recibieron el diagnóstico antes de los 9 meses tuvieron a los 8 años mejores resultados en las puntuaciones z para la comprensión lectora (diferencia media ajustada de 0,51; IC 95 %, 0,15 a 0,87; valor de p = 0,006) y para la escala de comunicación (diferencia media ajustada de 0,56; IC 95 %, 0,12 a 1,00; valor de p = 0,013) [51]. A los 17 años, el grupo de diagnóstico temprano tuvo resultados significativamente mejores en las puntuaciones z para la comprensión lectora (diferencia media ajustada de 1,17; IC 95 %, 0,36 a 1,97; valor de p = 0,005) y para el resumen de la lectura (diferencia media ajustada de 0,96; IC 95 %, 0,24 a 1,68; valor de p = 0,01) [52]. El beneficio en comprensión lectora se amplía en la adolescencia; la puntuación z permaneció con pocos cambios entre los 8 y los 17 años en el grupo de confirmación precoz, pero empeoró en la adolescencia en el grupo de diagnóstico tardío, lo que hizo que la diferencia en comprensión lectora pasara de moderada a grande. Aunque la tasa de abandonos limita el poder del estudio, las diferencias son estadísticamente significativas y tienen importancia clínica.
También se han evaluado las habilidades narrativas en un subgrupo de 89 niños de la misma cohorte que no usaban el lenguaje de signos como primer idioma (edad media de 7 años y 7 meses, rango de 6 a 10 años) y se han comparado con un grupo de 63 niños con audición normal [74]. El estudio se hizo pidiendo a los niños que repitieran el relato de un cuento breve con apoyo de dibujos y grabando los relatos, que fueron analizados midiendo diversas variables de forma estandarizada. El grupo de diagnóstico precoz (≤9 meses) tuvo mayor número de frases (diferencia media de 27; IC 95 %, 0,49 a 5,24; valor de p = 0,019), mejor estructura narrativa (odds ratio de 3,03; IC 95 %, 1,09 a 8,4; valor de p = 0,034) y mejor contenido narrativo (odds ratio de 4,43; IC 95 %, 1,52 a 12,89; valor de p =0,006) que el de diagnóstico posterior a los 9 meses, aunque las diferencias en el uso de frases con varias cláusulas y en el uso de simplificaciones fonológicas no fueron significativas.
En contraste, otro estudio de calidad moderada realizado en Australia, basado en un análisis retrospectivo de cohortes de base poblacional, mostró que los resultados en lenguaje y lectura a los 7-8 años estaban relacionados con la gravedad de la hipoacusia pero no con la edad de diagnóstico (Wake, 2005) [75]. Los niños incluidos habían nacido en el estado australiano de Victoria entre 1991 y 1993, en una época en la que no se había instaurado el cribado universal y la detección se hacía por factores de riesgo, además de aplicar a toda la población el test de distracción a los 8-10 meses. El estudio examinó la relación entre la edad al diagnóstico y los resultados en lenguaje receptivo, lenguaje expresivo, vocabulario receptivo, habla y comprensión lectora, medidos de forma estandarizada. La edad al diagnóstico no contribuyó significativamente a la varianza en las medidas del lenguaje, habla o lectura excepto en el vocabulario receptivo, que se acercó al nivel de significación estadística (cambio en R2 = 0,07, p = 0,05), y la gravedad de la afectación contribuyó significativamente a la varianza en todas las medidas excepto en la comprensión lectora. Dos limitaciones importantes de este estudio son el bajo número de niños identificados antes de los 6 meses (11 de 80, el 13 %) y la inclusión de niños con hipoacusia leve (17 de 80, el 21 %). Por otra parte, el estudio incluyó a 89 de 132 niños elegibles (67 %), pero después de haber sido completado los investigadores comprobaron que un grupo de 45 niños potencialmente elegibles no habían sido identificados por problemas administrativos.
El Longitudinal Outcomes of Children with Hearing Impairment (LOCHI) es un estudio prospectivo de cohortes de base poblacional [76], de buena calidad. Fueron invitados a participar todos niños con hipoacusia nacidos en tres estados australianos (Nueva Gales del Sur, Victoria y Queensland) durante el periodo de 5 años (2002 a 2007) en el que se llevó a cabo el despliegue del programa de cribado auditivo neonatal universal. En Nueva Gales del Sur el programa se puso en marcha simultáneamente en todas las regiones del estado, pero en Queensland y Victoria el proceso se hizo por etapas y se fueron incorporando progresivamente distintas regiones de ambos estados en periodos de 2 y 6 años respectivamente. De los 1020 niños invitados a participar, dieron el consentimiento 536 familias (53 %). Durante el periodo de seguimiento se perdieron 79 niños y otros 6 fallecieron, por lo que finalmente fueron incluidos un total de 451 niños, de los cuales 301 habían sido detectados por cribado neonatal universal y 239 habían recibido amplificación auditiva antes de los 6 meses. Había 86 niños (19 % del total) con hipoacusia leve, 149 (33 %) con hipoacusia moderada de 41 a 60 dB, 71 (18 %) con hipoacusia grave de 61 a 80 dB y 145 (32 %) con hipoacusia profunda ≥81 dB. A la edad de tres años, 134 niños tenían implantes cocleares y 46 de ellos lo habían recibido antes de los 12 meses. En la cohorte había 107 niños con alguna discapacidad asociada a la hipoacusia y 44 con diagnóstico de neuropatía auditiva. Según la información recogida de los padres, 302 niños usaban en casa una forma de comunicación oral, tres usaban lenguaje de signos y el resto una combinación de lenguaje oral y de signos. Las puntuaciones de nueve medidas de resultados fueron agrupadas en una puntuación global del lenguaje. Se hizo un análisis de regresión múltiple con la puntuación global del lenguaje como variable dependiente y un rango de características demográficas y de intervención como variables predictivas.
En el análisis a los tres años de edad, las medidas del lenguaje receptivo, leguaje expresivo y habla estaban alrededor de una desviación estándar por debajo de la media normativa (Ching, 2013) [77]. Entre las distintas variables analizadas en el análisis de regresión múltiple, la edad a la que se había activado el implante coclear influyó significativamente en la puntuación global del lenguaje (p = 0,04), pero la edad de inicio de la amplificación auditiva con audioprótesis no tuvo un valor significativo (p = 0,59). En los niños con implante coclear, retrasar la implantación de los 12 a los 24 meses de vida se asoció a una disminución en la puntuación global del lenguaje de 0,5 desviaciones estándar respecto a la puntuación que obtiene la población con audición normal [78]. Otros factores que influyeron en los resultados con un nivel de significación del 5 % fueron el sexo, la presencia de discapacidad asociada, el nivel de educación de la madre y la gravedad de la hipoacusia.
En el seguimiento hasta los 5 años, tanto la edad de inicio de la amplificación auditiva como la edad de activación del implante coclear tuvieron una influencia significativa en el desarrollo del lenguaje, que fue mayor cuanto más intensa era la pérdida auditiva (Ching, 2017) [54]. Las puntuaciones de 20 medidas fueron agregadas para obtener una puntuación global del lenguaje, que fue escalada para que la población normal tuviera una media de 100 y una desviación estándar de 15. Los niños que recibieron la audioprótesis a los 24 meses tuvieron menor puntuación que los que la recibieron a los 3 meses, y la diferencia fue mayor para las hipoacusias de 70 dB (-11,8 puntos; IC 95 %, -18,7 a -4,8) que para las de 50 dB (-6,8; IC 95 %, -10,8 a -2,8). Los niños tratados con implante coclear a los 24 meses tuvieron peor puntuación que los implantados a los 6 meses (-21,4; IC 95 %, -33,8 a -9).
En un estudio transversal, con una muestra de 101 niños que forman parte del estudio LOCHI, se analizaron los factores predictivos de la conciencia fonológica y la habilidad lectora a los 5 años [79]. Ni la amplificación temprana ni la edad de activación del implante tuvieron influencia significativa en la conciencia fonológica o en los resultados en lectura en esa cohorte, aunque el conocimiento de las letras se asoció significativamente a una menor edad de activación del implante.
En el subgrupo de niños con alguna discapacidad asociada, no hubo asociación significativa entre la edad de la edad de uso de los audífonos o del implante coclear y el rendimiento en el lenguaje o el habla a los tres años de edad [48], pero a los cinco tanto la edad de la amplificación como la edad de activación del implante coclear fueron predictivos para los resultados en el lenguaje receptivo y expresivo [80].
La revisión sistemática de Nelson para el USPSTF [13] encontró 9 estudios observacionales, 7 de ellos del estudio de Colorado (Yoshinaga-Itano), que describen mejores resultados en niños diagnosticados o tratados precozmente, pero todos tienen importantes limitaciones metodológicas (muestras de conveniencia, asignación no ciega, falta de información sobre abandonos y seguimiento, entre otros). Otro estudio observacional, también de calidad baja por tener limitaciones similares a los anteriores (Fitzpatrick, 2007) [55], no encontró diferencias significativas en las medidas del habla y del lenguaje entre los grupos con diagnóstico antes o después de los 12 meses.
Efectividad de los implantes cocleares
En niños menores de dos años el implante coclear está indicado en caso de hipoacusia neurosensorial profunda (>90 dB, que son el 20-30 % de las hipoacusias superiores a 40 dB [42]), y siempre que la cóclea y el nervio auditivo sean anatómicamente normales. La introducción del cribado universal en un amplio número de países ha permitido la identificación temprana de muchos niños con hipoacusia permanente, lo que ha dado lugar a una disminución en la edad de instalación de los implantes cocleares [81].
En niños con hipoacusia bilateral, hay cierta evidencia de que la disminución en la edad del implante produce beneficios en el desarrollo del lenguaje y del habla [82–85]. La revisión sistemática [84] más reciente concluye que, aunque no hay evidencia de nivel 1 y la mayoría de los trabajos publicados son estudios de cohortes con un riesgo de sesgo de moderado a alto, los estudios analizados mostraron una evidencia consistente de que los implantes cocleares deberían aplicarse en edades tempranas; sin embargo, la evidencia sobre los beneficios del implante antes de los 12 meses en todas las medidas del lenguaje y el habla es contradictoria.
Un estudio multicéntrico con 403 niños que recibieron el implante coclear antes de los 6 años, de los que 151 habían sido implantados antes de los 12 meses, mostró que el implante en el primer año de vida se asocia a beneficios significativos en las puntuaciones del lenguaje receptivo y expresivo, en el vocabulario receptivo y en la producción del habla [86]. El estudio no tuvo en cuenta variables que pueden afectar a los resultados, como la edad a la que se inició la amplificación auditiva, el nivel de educación materna, las diferencias socioeconómicas, las oportunidades lingüísticas en la familia o las condiciones médicas complejas de los pacientes incluidos.
4. ¿Cuáles son los efectos adversos del cribado de la hipoacusia congénita?
Las pruebas que se aplican para realizar el cribado, como las EOA o los PAEA, son procedimientos poco invasivos y no se han descrito problemas de seguridad relacionados con su aplicación para el cribado auditivo universal [16].
El cribado auditivo neonatal universal es generalmente bien aceptado y tolerado por los padres, con una tasa de rechazo a realizarlo inferior al 1 por 1000 [87,88]. La revisión de Nelson para el USPSTF [13] encontró dos estudios de cohortes de calidad moderada [89,90], uno de casos y controles de baja calidad [91] y 5 estudios de encuestas con tasa de respuesta mayor del 40 % que proporcionan información sobre los efectos adversos del cribado auditivo neonatal. Los padres muestran ansiedad cuando su hijo no pasa el cribado, pero se resuelve al confirmar el resultado normal y no se encuentran diferencias en el primer año de vida en las escalas de ansiedad o actitud hacia el niño entre los padres de niños que pasan el cribado y que no lo pasan. Los falsos negativos pueden crear una falsa sensación de seguridad y dar lugar a un retraso en el diagnóstico.
Otra revisión sistemática no encontró estudios fiables que permitan evaluar los efectos secundarios del cribado, aunque los autores señalan que el cribado tiene el riesgo potencial de efectos secundarios, principalmente en los falsos positivos [14].
5. ¿Cuáles son los efectos adversos del tratamiento de la hipoacusia congénita?
No hay estudios que hayan evaluado los efectos secundarios de la intervención temprana con audífonos u otras ayudas auditivas, ni de los efectos derivados del uso del lenguaje de signos, la terapia del lenguaje o la educación y apoyo a las familias [13].
Los implantes cocleares se asocian a un riesgo bajo de complicaciones quirúrgicas y meningitis bacteriana [92–95]. El implante antes de los 12 meses tiene la misma tasa de complicaciones medicoquirúrgicas que los realizados a los 12-18 meses [93].
En un estudio sobre los efectos psicológicos del implante coclear, los padres de 28 niños de 12 a 30 meses de edad que recibieron un implante coclear en Turquía señalaron que fue estresante tomar la decisión [96]. Estaban preocupados por el posible fracaso del dispositivo y el mantenimiento del equipo. Reconocieron que sus hijos necesitaban más apoyo familiar una vez recibido el implante y también señalaron beneficios en la comunicación, en la confianza en sí mismos, en el bienestar y en las relaciones sociales.
6. ¿Cuál es la efectividad y el coste-efectividad de los programas de cribado auditivo universal?
Un estudio retrospectivo sobre el rendimiento del cribado en el Reino Unido a lo largo de 7 años, con un total de 4 645 823 cribados (Wood, 2015) [30], comprobó que el 97,5 % de la población elegible había completado el cribado a las 4-5 semanas de edad y el 98,9 % lo había completado a los tres meses. La tasa de derivación de la cohorte de nacimiento en 2012-2013 fue del 2,6 %. El porcentaje de niños con cribado positivo que habían iniciado el estudio al mes y a los 6 meses de vida fue del 82,5 % y del 95,8 % respectivamente. La edad media de confirmación diagnóstica y de inicio de la amplificación auditiva fue disminuyendo a lo largo de los años incluidos en el estudio, situándose en la cohorte de 2012-2013 por debajo de los 3 meses para ambos parámetros. El número de casos detectados de hipoacusia bilateral ≥40 dB en la población general se aproximó a la cifra de 1 por 1000 nacidos. El valor predictivo positivo fue del 14 % para la población general, del 18,8 % para los ingresados en UCIN y del 12,4 % para los niños sanos.
Un estudio de los Centros para el Control y la Prevención de la Enfermedad (CDC) [97] encontró que, en Estados Unidos, entre los años 2006 y 2012 el número de niños sometidos a cribado universal pasó del 95,2 % al 96,6 %. En el mismo periodo, la tasa de derivación pasó del 2,3% al 1,6 % y la tasa de diagnóstico de hipoacusia entre los que no pasaron el cribado subió del 4,8 % al 10,3 %. El número de niños diagnosticados de hipoacusia que acudieron a los servicios de intervención varió del 55,4 % al 61,7 %, lo que indica que, a pesar de la mejoría, algo más de la tercera parte de los niños que precisan intervención no la reciben o al menos no consta en los registros.
Hay pocas evaluaciones económicas que hayan analizado el coste-efectividad a largo plazo del cribado auditivo neonatal universal, lo que puede ser atribuible a la incertidumbre sobre los beneficios a largo plazo obtenidos por la detección y tratamiento tempranos de la hipoacusia congénita. El impacto económico alcanzado a largo plazo por los programas de cribado puede verse atenuado por factores como la gravedad de la hipoacusia o la presencia de discapacidades asociadas.
Un análisis económico del Instituto de Economía de la Salud de Canadá [16] encontró cuatro estudios que cumplían los criterios de inclusión y solo uno de calidad aceptable [98], que examinó los costes y el coste-efectividad del cribado neonatal universal comparado con el test de distracción en Inglaterra, y por tanto no es de aplicación en nuestro ámbito.
Una revisión sistemática sobre el coste-efectividad de los programas de cribado auditivo neonatal universal encontró 22 evaluaciones observacionales o modelizadas, de las que solo dos comparaban el cribado neonatal universal de la hipoacusia bilateral con el cribado por factores de riesgo (Colgan, 2012) [99]. El resto hacían comparaciones entre diversas formas de cribado universal o incluían en el análisis las hipoacusias unilaterales. La única evaluación que analizó los costes y los resultados a largo plazo del cribado universal de la hipoacusia bilateral [100] encontró que el cribado universal podría ser coste-efectivo si diera lugar a una reducción importante en los costes futuros de tratamiento, educativos y en las pérdidas de productividad a lo largo de la vida, y esto es algo que no se ha estudiado adecuadamente.
El Instituto Aragonés de Ciencias de la Salud (IACS) [101], integrado en la Red Española de Agencias de Evaluación de Tecnologías Sanitarias, publicó en 2016 un informe de evaluación sobre la efectividad, seguridad y eficiencia del cribado neonatal de la hipoacusia, que incluye una revisión sistemática de los estudios de evaluación económica para determinar la estrategia de cribado más eficiente. Fueron incluidos 22 trabajos, de los que 9 comparaban el cribado universal frente al cribado en población con factores de riesgo. Los autores consideran que los estudios son de baja calidad y los resultados poco comparables entre sí por las diferencias que hay en las intervenciones, en las medidas de resultados y en el horizonte temporal, lo que impide obtener conclusiones sobre el coste-efectividad del cribado.
La Agencia de Evaluación de Tecnologías Sanitarias de Andalucía (AETSA) ha publicado un informe de respuesta breve, en el que se amplió la búsqueda de estudios de evaluación económica realizada por el IACS hasta junio de 2017 [102]. Encontró datos de una nueva evaluación económica en Taiwán, cuyos resultados no modifican las conclusiones del IACS.
7. ¿Cuál es la estrategia de cribado más efectiva?
No está definido cuál es el mejor protocolo de cribado y es habitual que cada país o región adopte un método concreto basado en el consenso de expertos [103,104]. Los protocolos pueden definir una estrategia común para toda la población neonatal o pueden diferenciar la pauta a seguir entre los niños sanos y los ingresados en UCIN o con factores de riesgo de hipoacusia. En cualquiera de las dos opciones los protocolos pueden ser de una, dos o tres etapas. El cribado con EOA en una etapa se asocia a un número elevado de falsos positivos y por esta razón es poco utilizado.
La estrategia más recomendada en recién nacidos sanos es un protocolo en dos etapas, con EOA como prueba inicial seguida de PAEA a los que no pasan las EOA [59,103]. Otros protocolos en dos etapas pueden consistir en EOA repetidas dos veces o PAEA repetidos dos veces. Con menor frecuencia se utiliza una estrategia en tres etapas, por ejemplo, EOA repetidas dos veces y seguidas de PAEA.
Los recién nacidos con enfermedades que requieren ingreso en UCIN por enfermedades como prematuridad, asfixia perinatal o hiperbilirrubinemia grave entre otras, tienen riesgo de desarrollar una neuropatía auditiva. En estos pacientes los potenciales evocados auditivos del tronco cerebral están ausentes o alterados, pero las emisiones otoacústicas son normales. Por esta razón, todos los niños que ingresan en una UCIN deben ser evaluados mediante PAEA antes del alta, aunque se les hubiera hecho previamente el cribado mediante EOA o PAEA [59,105].
Aunque la neuropatía auditiva es muy poco frecuente en la población de recién nacidos sanos, algunas instituciones han suprimido la estratificación por riesgos y realizan PAEA a todos los recién nacidos [103]. Esta estrategia permite detectar todos los casos de neuropatía auditiva. Cuando se utilizan los PAEA como prueba inicial en niños sanos, algunos protocolos derivan directamente a los niños que no pasan y otros indican una segunda prueba de PAEA antes de remitir para estudio audiológico.
En recién nacidos sanos con factores de riesgo de hipoacusia permanente (tabla 1) tampoco se conoce cuál es la mejor estrategia de cribado. El informe del IACS referido anteriormente sugiere que las EOA deberían ser la técnica inicial para el cribado universal y, en población de riesgo, la estrategia más eficiente sería la combinación de EOA y PAEA [101].
El programa de cribado auditivo neonatal universal de Castilla y León se puso en marcha a finales de 2004. Previamente, algunos hospitales hacían cribado mediante dos pruebas de EOA secuenciales. Aprovechando esta circunstancia, se han publicado dos estudios observacionales que comparan retrospectivamente el periodo de cribado con EOA y el periodo con PAEA iniciado tras la puesta en marcha del programa. El primero incluyó 2482 niños nacidos entre 2001 y 2003 y cribados con EOA al nacer y repetidas al mes si no pasaban la prueba, y 3129 niños nacidos entre 2004 y 2006 que fueron cribados con PAEA al nacer y repetidos al mes cuando no pasaron la primera prueba (Benito-Orejas, 2008) [106]. Se observó una tasa de derivación de la primera a la segunda etapa del cribado del 10,2 % para las EOA y del 2,6 % para los PAEA; la derivación de la segunda etapa para evaluación diagnóstica fue del 2 % para las EOA y del 0,32 % para los PAEA. Los autores llegan a la conclusión de que el mayor gasto que supone el cribado con PAEA compensa por el menor número de derivaciones que conlleva.
El otro estudio comparó 825 niños nacidos en el año 2003, que fueron cribados mediante EOA en dos etapas, con 2300 nacidos a partir de 2005 en los que el cribado se hizo mediante PAEA en dos etapas (Granell, 2008) [107]. En el periodo con EOA pasaron la primera fase del cribado el 91,8 %, frente a un 99,7 % con PAEA (p <0,0005). La participación en la segunda fase del cribado fue del 61,8 % con EOA y del 50 % con PAEA. Los autores indican que la evaluación de costes apunta a una diferencia cada vez más ajustada de ambas pruebas y concluyen que los PAEA podrían ser más coste-efectivos como prueba inicial de cribado, lo que se añadiría a la ventaja de la evaluación más completa de la vía auditiva.
Situación en España
El Consejo Interterritorial del Sistema Nacional de Salud aprobó en el año 2003 el programa de detección precoz de la hipoacusia [108], recomendando que se pusiera en marcha en todas las comunidades autónomas el cribado auditivo neonatal universal. Los requisitos básicos y mínimos establecidos en el programa son: detección precoz durante el primer mes de vida, acceso a la fase de diagnóstico a los tres meses o antes, tratamiento instaurado a los seis meses y seguimiento de todos los casos detectados.
En la actualidad todas las comunidades autónomas han desarrollado programas de detección precoz de la hipoacusia, siendo las últimas en incorporarse Madrid y Cataluña, que lo hicieron en el año 2010. En la mayoría de ellas el cribado se realiza mediante EOA: en algunas (Andalucía, Aragón, Canarias, Cantabria, Castilla-La Mancha*, Extremadura, Valencia y las ciudades autónomas de Ceuta y Melilla) se hace una segunda prueba de EOA a los que no pasan la primera y, en otras (Asturias, Murcia, Navarra), se hace una tercera prueba a los que no pasan la segunda, antes de remitir a los servicios de otorrinolaringología. De las comunidades que hacen el cribado mediante PAEA, en Castilla y León y en Cataluña se hacen dos pruebas secuenciales antes de derivar, mientras que en Galicia, Madrid y el País Vasco se deriva al recién nacido cuando no pasa la primera prueba.
La Comisión para la Detección Precoz de la Hipoacusia (CODEPEH) ha establecido unos criterios de calidad que deben cumplir los programas de detección precoz de la hipoacusia [105], en línea con los establecidos por el Joint Committee on Infant Hearing de los EE. UU. (JCIH) [11,59]:
- Cribado antes del primer mes de vida: >95 % de los recién nacidos.
- Segunda prueba en los que no pasaron la primera: >95 % de los derivados (debería tender al 100 %).
- Derivación para pruebas de confirmación: <4 %.
- Tasa de confirmación diagnóstica durante el tercer mes de vida: >90 % (debería tender al 100 %).
- Tasa de inicio de la intervención terapéutica en atención temprana ante de los 6 meses de edad: >90 % (debería tender al 100 %).
- Tasa de inicio de la adaptación protésica en el mes siguiente a la indicación: >95 % de los candidatos.
- Tasa de niños con control del desarrollo cognitivo y lingüístico antes de los 12 meses: >90 %.
- Registro informático de todos los niños y de los resultados en las distintas fases, con datos sobre:
- Número de recién nacidos cribados antes de abandonar el hospital.
- Número de niños con hipoacusia confirmada antes de los tres meses de edad.
- Número de niños incluidos en un programa de atención temprana antes de los seis meses de edad.
- Número de niños con sospecha de hipoacusia o confirmada que son remitidos a una unidad de hipoacusia infantil.
- Número de niños con hipoacusia no sindrómica que tienen un adecuado desarrollo del lenguaje y de las habilidades comunicativas al inicio de la edad escolar.
- Número de niños derivados a programa de implante coclear.
Teniendo en cuenta el coste que supone la puesta en marcha y el mantenimiento de un programa de cribado poblacional, cuyo objetivo es la participación en el cribado de una cifra cercana al 100 % de la población diana, resulta imprescindible conocer su efectividad y eficiencia para adecuar los recursos y evitar citas innecesarias a las familias. Aunque la recomendación del cribado se hizo desde un organismo estatal como es el Consejo Interterritorial, en el que están representadas todas las comunidades autónomas, la implementación y evaluación de los programas depende de cada comunidad autónoma y no hay un sistema centralizado de registro de datos que permita hacer estimaciones sobre su efectividad a nivel nacional. Se han publicado estudios o informes de evaluación de algunas comunidades autónomas [32,109–111], pero en general es llamativa la falta de datos que permitan evaluar la efectividad y los resultados de los programas en marcha. En Madrid nacieron 65 317 niños en el año 2013 y, según datos de la Consejería de Sanidad, solo fueron incluidos en el registro mecanizado del cribado 29 983, un 45,9 % de todos los nacidos [112].
La falta de datos sobre los resultados del programa de detección precoz de la hipoacusia en nuestro medio impide conocer su efectividad y saber si se están cumpliendo los estándares de calidad definidos en por el Consejo Interterritorial y por la CODEPEH. Un problema detectado con frecuencia en los programas de cribado auditivo neonatal, del que tampoco disponemos de datos globales en España y que puede influir de forma significativa en su efectividad, es el elevado número de niños derivados que se pierden para el seguimiento [113].
Es primordial que todas las comunidades autónomas hagan públicos los datos anuales de los registros sobre el cribado auditivo, que deben contener información sobre los criterios de calidad establecidos por el Consejo Interterritorial y por la CODEPEH. Y también sería deseable que, como ocurre en otros países [114,115], hubiera un registro centralizado que permita obtener datos de efectividad a nivel nacional.
(*) La primera fase de cribado auditivo puede realizarse tanto por EOA como por PAEA. En caso de no superar el cribado con PAEA, son derivados directamente para confirmación diagnóstica.
CRIBADO POSNATAL DE LA HIPOACUSIA
La prevalencia de hipoacusia permanente se dobla entre el nacimiento y los 5 años [1]. Las causas son hipoacusias congénitas de inicio tardío, hipoacusias de adquisición posnatal o bien falsos negativos que quedaron sin identificar en el cribado neonatal, aunque estos últimos son poco frecuentes.
La inmensa mayoría de las hipoacusias que ocurren en la infancia son leves y temporales, secundarias a otitis media serosa. Este trastorno afecta a casi todos los niños en algún momento y a aproximadamente el 5 % de la población en un momento dado. No cumple los criterios de cribado poblacional porque es transitorio, la pérdida auditiva suele ser leve, el tratamiento solo logra un beneficio temporal con riesgo de efectos secundarios y el pronóstico a largo plazo es similar al de los que no lo padecen.
No hay estudios con alto nivel de evidencia que analicen la detección de la hipoacusia posnatal. Una búsqueda sistemática de los estudios publicados desde 2005 solo encontró 18 estudios con bajo nivel de evidencia, que fueron heterogéneos en cuanto a la selección de los participantes, metodología y resultados [116].
Seguimiento de niños con factores de riesgo
Hay pocos datos sobre la contribución relativa de la sordera congénita y la posnatal al conjunto de pacientes con hipoacusia permanente, y tampoco se conoce bien la edad óptima para la detección de la hipoacusia de inicio posnatal. El JCIH definió en 2007 once categorías de factores de riesgo asociados a la hipoacusia y ocho indicadores asociados a un mayor riesgo de hipoacusia de inicio tardío [59]. El JCIH recomienda que los niños con un factor de riesgo incluido en alguna de las once categorías reciban al menos una evaluación audiológica entre los 24 y los 30 meses, aunque en algunos casos, como en la infección por CMV, propone un seguimiento más frecuente. La infección intrauterina por virus del Zika puede causar hipoacusia congénita, pero en el momento actual no hay pruebas de que se asocie a hipoacusia de inicio tardío [117].
La recomendación del JCIH ha sido objeto de crítica porque no hay evidencia de que todos los factores de riesgo que propone se asocien a hipoacusia posnatal, por el elevado número de niños que desarrollan hipoacusia posnatal sin tener factores de riesgo, por las dificultades para identificar y recoger todos los factores de riesgo de forma fiable, porque muchos no acuden a las citas programadas y por las dificultades para identificar la hipoacusia en niños pequeños [118].
El mayor estudio sobre la efectividad del seguimiento de niños con factores de riesgo para la detección de hipoacusia posnatal está basado en una muestra de 2,3 millones de niños nacidos en Inglaterra entre 2006 y 2009 [119]. El programa de cribado auditivo universal detectó 69 050 niños que pasaron el cribado auditivo y tenían factores de riesgo, de los que 38 192 (55,3 %) acudieron a las citas de seguimiento. La prevalencia de hipoacusia permanente ≥40 dB en los niños con factores de riesgo que habían pasado el cribado neonatal fue de 1,49 por 1000. Los cinco indicadores asociados a una mayor prevalencia de hipoacusia tardía fueron (tabla 2): síndromes asociados a hipoacusia, niños ingresados en UCIN que pasan los PAEA pero no pasan las EOA*, anomalías craneofaciales (excluidos apéndices y fositas preauriculares), síndrome de Down e infecciones congénitas (citomegalovirus, rubeola o toxoplasmosis). La meningitis bacteriana no fue incluida porque todos los niños con este trastorno son remitidos para evaluación audiológica; asimismo, los niños que reciben ventilación con ECMO tienen un protocolo específico de seguimiento que determina la necesidad de evaluación auditiva.
Otros factores de riesgo como historia familiar de hipoacusia infantil permanente, administración de aminoglucósidos (salvo que se hayan excedido los niveles terapéuticos o haya sospecha de mutación mitocondrial A1555G), ventilación prolongada, ictericia que precisa exanguinotransfusión, ingreso en UCIN >48 horas, enfermedades neurodegenerativas o trastornos del neurodesarrollo tuvieron un bajo rendimiento para la detección de hipoacusias tardías en niños que habían pasado el cribado neonatal y han sido suprimidos como indicadores de seguimiento posnatal en el programa de cribado auditivo [120]. Utilizando los cinco factores de riesgo mencionados, el porcentaje de niños que requieren seguimiento se reduce del 3 % al 0,25 %.
Tabla 2. Factores de riesgo de hipoacusia posnatal (Wood, 2013) [119].
| Factor de riesgo |
N |
N con HA
|
Preval./1000 |
| Síndromes asociados a hipoacusia |
1243 |
9 |
7,2 |
| UCIN con paso EOA y fallo PAEA |
3494 |
20 |
5,7 |
| Anomalías craneofaciales* |
4011 |
19 |
4,7 |
| Síndrome de Down |
1107 |
4 |
3,6 |
| Infección congénita |
1120 |
3 |
2,7 |
| Historia familiar (padres o hermanos) |
27848 |
58 |
2,1 |
| Ventilación PPI >5 días o ECMO |
5228 |
9 |
1,7 |
| Enf. neurodegenerativa/neurodesarrollo |
1462 |
2 |
1,4 |
| Ictericia a nivel de exanguinotransfusión |
2634 |
3 |
1,1 |
| Historia familiar amplia |
66754 |
75 |
1,1 |
| UCIN >48 horas |
111748 |
71 |
0,6 |
| Sin riesgo |
35280 |
213 |
0,1 |
(*) Excepto apéndices y fositas preauriculares
Abreviaturas: ECMO: oxigenación por membrana extracorpórea. HA: hipoacusia UCIN: unidad de cuidados intensivos neonatales
Un estudio de evaluación de un programa de seguimiento de niños con factores de riesgo en el estado australiano de Queensland incluyó 7320 niños con factores de riesgo de una población de 261 328 recién nacidos, de los que 2107 completaron las citas de seguimiento [121,122]. Los factores de riesgo que tuvieron mayor rendimiento para la detección de hipoacusia posnatal fueron, en orden decreciente, los síndromes asociados a hipoacusia, historia familiar, anomalías craneofaciales, asfixia grave e infecciones congénitas. Sin embargo, estos datos no se pueden comparar con los del programa inglés porque se incluyeron hipoacusias leves (50,0 % de todas las detectadas) e hipoacusias de conducción (24,9 %), que suelen ser transitorias. En el caso concreto de los antecedentes familiares, en un análisis posterior los autores indican que el 87 % de los casos de hipoacusia detectados eran de conducción, y entre las neurosensoriales había un predominio de las de grado leve [123]. Por otra parte, solo 28,8 % (2017/7320) de los que tenían factores de riesgo completaron el estudio, y en el subgrupo con antecedentes familiares este porcentaje fue del 16,6 % (494/2968). Entre los 2017 que completaron el estudio, había 905 con peso al nacer <1500 g y solo 4 de ellos desarrollaron hipoacusia posnatal, lo que supone que el rendimiento del peso <1500 g como factor de riesgo es del 0,4 %. En base a este estudio y a una revisión sistemática de la literatura [118], los autores han publicado una clasificación de cada factor de riesgo según la evidencia disponible [124] (tabla 3), en la que se recomienda el seguimiento (grado A) en niños con historia familiar, anomalías craneofaciales, ventilación con ECMO o infección congénita por citomegalovirus; se sugiere (grado B) en caso de ventilación asistida >5 días o síndromes asociados a hipoacusia y no se recomienda (grado E) cuando el factor de riesgo es el bajo peso al nacimiento (<1500 g). Sin embargo, aunque el peso en sí mismo no sea un factor de riesgo, estos niños tienen factores concurrentes como estancia en UCIN, ventilación mecánica, hiperbilirrubinemia, infección por citomegalovirus u otros que pueden justificar la necesidad del seguimiento auditivo.
Tabla 3. Clasificación de los factores de riesgo por grado de evidencia (Beswick, 2012) [124].
| Grado |
Factor de riesgo |
Grado A
Recomendación de seguimiento |
- Historia familiar de hipoacusia permanente en padres o hermanos
- Anomalías craneofaciales (excepto apéndices y fositas preauriculares)
- Ventilación con ECMO
- Infección congénita por citomegalovirus
|
Grado B
Posible recomendación de seguimiento |
- Síndromes asociados a hipoacusia (Down, síndrome alcohólico fetal)
- Ventilación asistida neonatal >5 días
|
Grado C
Falta de evidencia |
- Asfixia grave al nacimiento
- Infecciones congénitas, excluidos CMV y toxoplasmosis (herpes, sífilis, rubeola)
|
Grado D
Posible recomendación de no hacer seguimiento |
- Meningitis bacteriana (confirmada o sospechada)
- Hiperbilirrubinemia >450 µmol/L en niños a término o >340 µmol/L en prematuros
- Preocupación del profesional
|
Grado E
Recomendación de no hacer seguimiento |
- Bajo peso al nacimiento (<1500 g)
- Toxoplasmosis congénita
|
Abreviaturas: CMV: citomegalovirus. ECMO: oxigenación por membrana extracorpórea.
Un estudio retrospectivo de 115 309 niños nacidos en el estado norteamericano de Iowa entre 2010 y 2012 encontró que 11 304 (10 %) tenían uno o más factores de riesgo de hipoacusia [125]. Entre los 23 factores de riesgo analizados, los que se asociaron a un mayor riesgo de hipoacusia posnatal permanente a los tres años de edad fueron la infección congénita por citomegalovirus (odds ratio = 98,05, IC 95 % 25-349), los síndromes asociados a hipoacusia (odds ratio = 58,38, IC 95 % 33-101) y las anomalías craneofaciales (odds ratio = 50,62, IC 95 % 32-80). En orden decreciente, otros factores de riesgo que también se asociaron a hipoacusia tardía fueron el ingreso en UCIN durante más de 5 días, la administración de fármacos ototóxicos, la meningitis, el test de Apgar menor de ≤6 a los 5 minutos o ≤4 al minuto, la ventilación mecánica, el peso al nacer <1500 g, la preocupación familiar y los antecedentes familiares.
Los resultados de estos estudios apoyan el seguimiento auditivo de los niños que pasan el cribado pero tienen factores de riesgo para desarrollar hipoacusia posnatal [116].
(*) En Inglaterra, el cribado de los niños ingresados en UCIN se hace con EOA y PAEA [120]
Cribado en la edad escolar
Una revisión realizada con metodología de evaluación rápida de la evidencia [116] encontró en la bibliografía publicada sobre el cribado de la hipoacusia en atención primaria una serie de dificultades como la factibilidad en los niños más pequeños, la falta de seguimiento de los que precisan una repetición del cribado o una evaluación diagnóstica [126] o el hecho de que la mayoría de los casos detectados serían hipoacusias de conducción, leves y transitorias, más que casos de hipoacusia permanente. Los autores concluyen que el cribado auditivo en atención primaria no está justificado.
Una revisión de buena calidad sobre el programa de cribado auditivo al inicio de la escolarización (4-5 años) en el Reino Unido [127] encontró que los audiómetros portátiles para cribado tienen una sensibilidad del 83-89 % y una especificidad del 78-83 %. El cribado no detecta más casos de hipoacusia que cuando no se hace y los niños son derivados por sospecha de los padres, profesores o sanitarios. Tampoco disminuye la edad de la detección, aunque evita derivaciones, que son más frecuentes en ausencia de cribado. No fue posible cuantificar el efecto del cribado en los falsos negativos, aunque la tasa es muy baja. En una encuesta a los padres se observó que las consecuencias del proceso de derivación, incluidos los falsos positivos, son leves.
VALORACIÓN DE LA EVIDENCIA
No hay ensayos aleatorizados que hayan comparado el cribado auditivo universal frente al cribado por factores de riesgo o frente a la ausencia de cribado. Los estudios que han analizado el resultado del cribado han obtenido resultados variables que no permiten valorar los beneficios del cribado [28,29,50–54].
Los programas de cribado tienen unos niveles aceptables de sensibilidad, especificidad y tasas de derivación [7,16]. No obstante, es preciso tener en cuenta que en la práctica son muchos los factores que influirán en la validez (sensibilidad y especificidad) del cribado, entre los que se incluyen el grado de entrenamiento de las personas que lo aplican, la calibración del equipo de cribado, el ruido ambiental en la habitación donde se realiza, los algoritmos de pasa/no pasa usados por los fabricantes o el número de intentos de cribado hechos a cada niño [128]. Como es de esperar en el despistaje de trastornos con baja prevalencia, el valor predictivo positivo es bajo y la mayoría de los casos que no pasan el cribado son falsos positivos.
Hay pruebas sólidas de que el cribado neonatal universal adelanta significativamente la edad de diagnóstico e inicio de la intervención de la hipoacusia permanente. La evidencia incluye un ensayo controlado realizado en la región inglesa de Wessex [62,63], dos estudios cuasi-aleatorizados de base poblacional procedentes de los Países Bajos [29] y Australia [53] y la evaluación de múltiples programas de cribado neonatal implementados a lo largo del mundo. El cribado neonatal permite confirmar el diagnóstico de hipoacusia antes de los 6 meses [30], frente a los 2 años de media en los pacientes no sometidos a cribado. El cribado limitado a la población de riesgo identifica solo al 50-60 % de los recién nacidos con hipoacusia, lo que supone que el otro 40-50 % será diagnosticado a una edad tardía.
Los estudios de calidad buena a moderada que han evaluado los efectos del adelanto diagnóstico y terapéutico de la hipoacusia en el lenguaje están resumidos en la tabla 4. En uno, de buena calidad, se observaron a los 6-10 años (edad media de 8 años) beneficios del adelanto de la edad del diagnóstico, pero en el seguimiento de la cohorte hasta los 13-19 años (edad media de 17 años) las diferencias dejaron de ser estadísticamente significativas tanto para los grupos de diagnóstico precoz o tardío [28,50]. Durante el seguimiento de 9 años entre la edad escolar y la adolescencia se perdieron el 50 % de los pacientes, lo que limita la potencia de los resultados a los 17 años. En esta cohorte se han analizado también los resultados en lectura, y el grupo de diagnóstico temprano obtuvo mejores resultados en comprensión lectora tanto a los 8 como a los 17 años [51,52].
Tabla 4. Resumen de estudios sobre los beneficios de la intervención precoz en el lenguaje.
| Estudio |
Datos del estudio |
Calidad |
Beneficio |
| Kennedy, 2006 [28] |
Base comunitaria
Participación 71%
Ciego
Posible infraestimación del beneficio (mejor tratamiento en la actualidad) |
Buena |
Sí |
| Pimperton, 2017 [50] |
Cohorte del estudio anterior seguida hasta la adolescencia
Pérdida del 50 % |
Moderada |
No |
| Ching, 2013 [77] |
Prospectivo de cohortes
Participan 451 (cálculo tamaño muestra: 400)
Evaluación ciega en la medida de lo posible
Incluyen HA leves |
Buena |
Sí en IC
No en audioprótesis |
| Ching, 2017 [54] |
Cohorte del estudio anterior seguida hasta los 5 años
Participan 350
Excluyen a los que tienen pérdida auditiva progresiva (n = 88), lo que impide que los resultados sean generalizables a toda la población |
Buena |
Sí, tanto en IC como en audioprótesis |
| Wake, 2005 [75] |
Base poblacional
Participación 67% (50% si se tienen en cuenta 45 elegibles no detectados)
Evaluación ciega
Solo el 13% eran <6 meses
Incluye HA leves |
Moderada |
No |
| RS beneficios IC [84] |
No hay evidencia de nivel 1
Estudios con riesgo de sesgo de moderado a alto
Evidencia consistente |
Moderada |
Sí |
Abreviaturas: HA: hipoacusia. IC: implante coclear. RS: revisión sistemática. TM: tamaño de la muestra.
En otro estudio de buena calidad, la edad de activación del implante coclear tuvo influencia significativa en la puntuación global del lenguaje a los 3 años, aunque la edad de inicio de la amplificación auditiva no tuvo valor estadísticamente significativo [77]. Sin embargo, a los 5 años los beneficios de la intervención precoz fueron evidentes tanto para los que habían recibido un implante coclear como para los tratados con audioprótesis y, en estos pacientes, el beneficio fue mayor en los que tenían mayor grado de hipoacusia [54]. Por último, en otro estudio de calidad moderada la edad de diagnóstico no tuvo influencia significativa en el lenguaje a los 8 años [75].
En resumen, la evidencia sobre los beneficios del adelanto diagnóstico de la hipoacusia permanente en el desarrollo del lenguaje es contradictoria. En conjunto, hay una tendencia a obtener un resultado positivo, aunque muchas veces el seguimiento ha sido a lo sumo hasta la edad escolar. Solo hay un estudio que haya analizado los resultados hasta la adolescencia, pero la elevada pérdida de pacientes durante el seguimiento limita la calidad del estudio. Es una cohorte de niños en los que previamente se habían observado beneficios a los 8 años que motivaron el cambio en la recomendación del USPSTF en 2008, y los resultados son decepcionantes, pues las ventajas del cribado y del adelanto diagnóstico dejan de ser significativas en la adolescencia.
Los resultados del implante coclear en la evolución del lenguaje y el habla han sido objeto de diversos estudios y revisiones. En niños con hipoacusia bilateral, hay evidencia consistente, aunque basada en estudios de calidad moderada a baja, sobre los beneficios de la disminución de la edad del implante en el desarrollo del lenguaje y del habla [84]. El beneficio adicional de realizar el implante antes de los 12 meses de vida no está bien definido.
El cribado auditivo universal es bien aceptado por las familias. El número elevado de falsos positivos puede generar ansiedad en los padres, pero hay evidencia de que tiene una duración limitada, sobre todo cuando existe una comunicación adecuada entre la persona que hace el cribado y la familia.
La evidencia sobre los efectos secundarios del tratamiento precoz es escasa. El implante coclear tiene una tasa baja de complicaciones, independientemente de la edad a la que se realice la intervención. Los estudios de coste-efectividad son muy escasos. No hay evidencia de que el cribado auditivo neonatal universal genere valor por dinero.
En conclusión (tabla 5), hay buena evidencia sobre la eficacia y seguridad de las pruebas de cribado auditivo neonatal universal para adelantar la edad de diagnóstico, pero la evidencia acerca de los beneficios del cribado o del adelanto diagnóstico en los resultados del lenguaje es de baja calidad. Son necesarios estudios adicionales que permitan conocer la efectividad del programa completo, pues el resultado final depende tanto del cribado en sí como de los procedimientos de derivación, diagnóstico y tratamiento. Es esencial que los programas de cribado auditivo neonatal tengan establecido un sistema de control de calidad que permita su reevaluación periódica y la puesta en marcha de estrategias de mejora.
Tabla 5. Cribado auditivo neonatal universal: resumen de la evidencia
Balance entre beneficios y riesgos
- El adelanto en el tratamiento produce beneficios y los riesgos son escasos:
|
Calidad global de la evidencia
- Validez de las pruebas de cribado y eficacia para adelantar la edad de diagnóstico:
- Eficacia del tratamiento para mejorar los resultados en lenguaje:
|
Valores y preferencias
- El cribado es bien aceptado y tolerado por las familias
- Las familias prefieren el diagnóstico precoz [129]
- La recomendación a favor del cribado es unánime
- Factibilidad de implementar la recomendación: el programa de cribado está ya puesto en marcha en todas las comunidades autónomas
|
Uso de recursos y costes
- La escasez de estudios no permite extraer conclusiones sobre el coste-efectividad de los programas de cribado neonatal universal
|
Después del periodo neonatal, la evidencia apoya el seguimiento de los niños con factores de riesgo para la detección de la hipoacusia de inicio posnatal [116].
En la edad escolar hay un claro predominio de hipoacusias de conducción, leves y transitorias, sobre las hipoacusias permanentes. Es poco probable que el cribado auditivo a los 4-5 años sea eficaz para aumentar el número de casos con hipoacusia identificados o para reducir la edad media de la identificación y, por tanto, es poco probable que represente una buena opción en términos de valor por dinero [127].
RECOMENDACIONES DE OTROS GRUPOS
| Organización |
Recomendaciones |
| USPSTF (2008) [130] |
Cribado neonatal universal |
| JCIH (2007) [59] |
Cribado neonatal universal |
| CPS (2011) [131] |
Cribado neonatal universal |
| G-BA (2008) [132] |
Cribado neonatal universal |
| OMS (2009) [133] |
Cribado neonatal universal |
| NSC-UK (2006) [134] |
Cribado neonatal universal |
| CCCH-AU (2009) [135] |
Cribado neonatal universal |
| MSSSI – CODEPEH (2003) [108] |
Cribado neonatal universal |
Abreviaturas: CCCH-AU: Center for Community Child Health - Australia.
CODEPEH: Comisión para la Detección Precoz de la Sordera Infantil.
CPS: Canadian Paediatric Society. G-BA: Federal Joint Committee (Germany).
JCIH: Joint Committee on Infant Hearing. MSSI: Ministerio de Sanidad, Servicios
Sociales e Igualdad. NSC-UK: National Screening Committee – United Kingdom. OMS: Organización Mundial de la Salud. USPSTF: United States Preventive
Services Task Force.
RECOMENDACIONES DE PREVINFAD
Cribado neonatal
Tras evaluar los factores expuestos en la tabla 5, se sugiere realizar el cribado auditivo neonatal universal, por considerar que puede existir un beneficio neto asociado a su aplicación.
Recomendación:
- Se sugiere hacer el cribado auditivo neonatal universal (débil a favor).
Cribado posnatal
Recomendación:
- Se sugiere hacer el seguimiento de los niños con factores de riesgo (débil a favor).
- Se sugiere no hacer cribado de la hipoacusia en la edad escolar (débil en contra).
ANEXO I. ESTRATEGIA DE BÚSQUEDA BIBLIOGRÁFICA
Palabras clave:
- Descriptores MESH: hearing loss; neonatal screening; mass screening; cochlear implants.
- Descriptores DeCS: pérdida auditiva; tamizaje neonatal; tamizaje masivo; implantes cocleares.
Bases de datos:
- MEDLINE/PubMed; Embase.
- IBECS; IME.
Medline (PubMed):
- ("Hearing Loss"[Mesh]) AND ("Mass Screening"[Mesh] OR "Neonatal Screening"[Mesh])ç
- "Cochlear Implants"[Mesh] AND ("humans"[MeSH Terms] AND ("infant"[MeSH Terms] OR "child"[MeSH Terms]))
- (("Hearing Loss"[Mesh]) AND ("Mass Screening"[Mesh] OR "Neonatal Screening"[Mesh])) AND "Review" [Publication Type]
- "Cochlear Implants"[Mesh] AND ("humans"[MeSH Terms] AND ("infant"[MeSH Terms] OR "child"[MeSH Terms])) AND "Review"[Publication Type]
Bibliotecas:
- Cochrane Library/Biblioteca Cochrane Plus;
- DARE/ HTA database (http://www.crd.york.ac.uk/CRDWeb)
- Trip Database;
- BVS; SciELO; Epistemonikos;
- National Guideline Clearinghouse; NICE; ACP Guidelines Web site;
La búsqueda se ha complementado con el análisis de las referencias incluidas en los estudios inicialmente encontrados y con una alerta bibliográfica en PubMed hasta diciembre de 2017.
ANEXO II. GLOSARIO DE TÉRMINOS
Audición binaural: audición con ambos oídos.
Audífono: dispositivo electrónico que amplifica y modifica las señales sonoras para permitir una mejor comunicación. Consta de un micrófono que convierte las ondas sonoras en señales eléctricas y de un amplificador que modula estas señales y envía el sonido a través de un auricular.
Audiograma: registro de los umbrales de la agudeza auditiva para varias frecuencias de sonido.
Audiometría: medición por aparatos electroacústicos de la cantidad y calidad de la audición en toda la escala tonal de 125 a 12.000 Hz. En una audiometría se valora a partir de qué intensidad (dB) comenzamos a oír en una frecuencia concreta (por ejemplo, 1000 Hz).
Audioprótesis: audífono.
Belio: unidad de intensidad acústica que se expresa como el logaritmo decimal del cociente entre la presión producida por una onda y una presión de referencia.
Cofosis: pérdida completa de la capacidad auditiva.
Conciencia fonológica: habilidad metalingüística que permite comprender que las palabras están constituidas por sílabas y fonemas. Es una capacidad fundamental para el aprendizaje de la lectura.
Decibelio (dB): unidad relativa y logarítmica que se utiliza para determinar la relación entre dos potencias acústicas o eléctricas. No es una unidad de medida. Un belio (10 dB) representa un aumento de potencia de 10 veces sobre la magnitud de referencia, y dos belios indican un aumento de 100 veces en la potencia. El oído humano se mueve en un rango de 0 a 120 dB.
Dislalia: alteración en la articulación de los fonemas.
Emisiones otoacústicas (EOA): sonidos de baja intensidad que emiten las células ciliadas externas de la cóclea al vibrar por estimulación de los sonidos.
Habla: expresión oral del lenguaje.
Hercio (Hz): unidad de frecuencia. En física se usa para medir la cantidad de veces por segundo que se repite una onda sonora o electromagnética. Un hercio representa un ciclo por segundo. Los sonidos graves tienen frecuencias bajas y los agudos frecuencias altas.
Hipoacusia: disminución de la capacidad auditiva.
Hipoacusia conductiva o de transmisión: pérdida auditiva causada por alteraciones en la transmisión del sonido en el oído externo o en el oído medio. La pérdida auditiva puede ser transitoria, por presencia de líquido en el oído medio, o de causa anatómica y permanente.
Hipoacusia neurosensorial o perceptiva: hipoacusia causada por lesiones en el oído interno (células ciliadas del órgano de Corti) o, con menos frecuencia, en la vía nerviosa auditiva o en la corteza cerebral.
Hipoacusia poslocutiva: hipoacusia que aparece después de la adquisición el lenguaje.
Hipoacusia prelocutiva: la que surge antes de desarrollo del lenguaje (en los primeros tres años de vida).
Implante coclear: dispositivo electrónico que transforma los sonidos en impulsos eléctricos y los traslada a la cóclea, lo que permite que lleguen al nervio coclear y al centro auditivo del cerebro, donde son descodificados.
Lenguaje: capacidad propia del ser humano de expresar pensamientos e intercambiar información compleja y abstracta. No es exclusivamente oral.
Lenguaje expresivo: capacidad para expresar pensamientos e ideas.
Lenguaje receptivo: capacidad para entender el mensaje que proviene de otros
(lo que otros están diciendo).
Neuropatía auditiva: trastorno auditivo caracterizado por una disfunción en el procesamiento neuronal de los estímulos auditivos y en el que puede estar afectado el octavo par craneal, el tronco cerebral o el córtex auditivo. El funcionamiento de las células ciliadas externas de la cóclea es normal.
Percepción del habla: proceso de identificación de los sonidos del lenguaje.
Potenciales auditivos evocados: respuesta neuroeléctrica del sistema auditivo (desde el nervio auditivo hasta el tubérculo cuadrigémino inferior, situado en el tronco encefálico) ante un estímulo sonoro.
Potenciales auditivos evocados automatizados (PAEA): sistema computarizado de registro de los potenciales auditivos evocados que se utiliza como prueba de cribado auditivo.
Producción del habla: secuencia de movimientos de las estructuras musculares implicadas en la articulación de los sonidos.
Prótesis auditiva: audífono.
Sordera: pérdida total de la audición en uno o ambos oídos.
Test de distracción: prueba subjetiva de valoración auditiva aplicable entre los 6 y 24 meses. Se producen sonidos por detrás y a los lados del niño tras mostrarle un juguete y se comprueba si trata de localizar el sonido.
Vocabulario expresivo: conjunto de palabras que emplea un hablante.
Vocabulario receptivo: conjunto de palabras que un hablante entiende cuando las oye o las lee.
ANEXO III. DESCRIPCIÓN DE LAS PRUEBAS DE CRIBADO
Las técnicas que se utilizan habitualmente en el cribado auditivo neonatal son las EOA y los PAEA. Estos métodos registran de forma no invasiva la actividad fisiológica de la función auditiva, pero no proporcionan una medida directa de la audición. En ambos casos se emplean sistemas automatizados que determinan mediante un algoritmo matemático si la respuesta registrada es normal (pasa) o anormal (no pasa), pero no permiten establecer un diagnóstico de hipoacusia. Los niños que no pasan el cribado deben ser sometidos a una evaluación audiológica en un servicio de otorrinolaringología.
Tanto las EOA como los PAEA son en la actualidad pruebas fáciles de aplicar y no requieren personal con un alto nivel de entrenamiento, pero el mantenimiento de los equipos y la inversión en recursos humanos, que deben conocer la técnica de aplicación, tienen un coste significativo.
La prueba de las EOA se basa en el sonido que emiten las vibraciones de las células ciliadas externas de la cóclea al contraerse en respuesta a los sonidos, que se transmite por el oído medio y puede ser detectado en el conducto auditivo externo. Durante el cribado se instala una pequeña sonda en el conducto auditivo que contiene un altavoz y un micrófono. El altavoz emite un sonido que se transmite por oído medio hasta el oído interno, donde las células externas de la cóclea producen una respuesta activa o emisiones. Estas emisiones son recogidas por el micrófono. Para que el resultado sea válido la sonda debe quedar bien ajustada en el conducto auditivo y no debe haber mucho ruido ambiental.
Hay dos tipos de EOA que pueden utilizarse como prueba de cribado. Las emisiones otoacústicas transitorias (EOAT) se producen en respuesta a un estímulo breve, como un clic o un estallido tonal, y son las más utilizadas en el cribado de la hipoacusia. Con menos frecuencia se emplea la técnica de los productos de distorsión (EOAPD), que se producen por estimulación con dos tonos puros, de distinta frecuencia, presentados de forma simultánea. Las EOAT indican la presencia o ausencia de umbrales auditivos superiores a 30 dB, mientras que las EOAPD realizan una audiometría objetiva entre 1000 y 6000 Hz [136].
Los PAEA miden la respuesta neuroeléctrica del sistema auditivo desde el nervio auditivo hasta el tubérculo cuadrigémino inferior, situado en el tronco del encéfalo. Unos auriculares instalados en ambas orejas emiten un estímulo sonoro, generalmente a 35 dB, y tres electrodos situados en la frente, la nuca y la región mastoidea o el hombro recogen la respuesta eléctrica del sistema auditivo. La medición automatizada de los potenciales auditivos evocados solo se utiliza para el cribado y es una prueba distinta de la medición no automatizada que se usa con fines diagnósticos, que proporciona datos cuantitativos y debe ser interpretada por personal especializado.
Las EOA valoran la capacidad del sistema auditivo periférico y detectan alteraciones a nivel de la cóclea, pero no detectan la neuropatía auditiva, que tiene una prevalencia baja (<1/10 000) en recién nacidos que no precisan ingreso [137–139]. Los PAEA evalúan la vía del nervio auditivo hasta el tronco cerebral y permiten detectar la neuropatía auditiva además de las alteraciones cocleares. Ninguna de las dos pruebas evalúa las hipoacusias de origen cortical que pueden estar causadas por asfixia grave o por una infección congénita por citomegalovirus.
El tiempo de realización de las EOA es de uno o dos minutos por oído en condiciones ideales. Los PAEA precisan de 4 a 15 minutos, aunque con los equipos más modernos el tiempo puede reducirse a 4-8 minutos si se dan las condiciones ideales. Los PAEA requieren que el niño esté tranquilo o dormido para evitar los artefactos musculares. Las EOA pueden hacerse con el niño despierto, mientras se alimenta o usa un chupete, aunque el tiempo de respuesta es menor si está dormido o tranquilo.
Las EOA tienen mayor riesgo de falsos positivos por ocupación del conducto auditivo externo o el oído medio, sobre todo si se realizan en las primeras 48 horas de vida, así como por la presencia de ruido ambiental. Las EOA también producen tasas altas de derivación si se exploran a frecuencias bajas (1-4 kHz), porque la presencia de líquido amniótico y mesénquima en el oído medio en los primeros días de vida afecta sobre todo a la transmisión de los sonidos de baja frecuencia. El cribado a frecuencias más altas (2-4 o 2-5 kHz) tiene menores tasas de derivación dado que se afecta menos por la ocupación del oído medio [57,140].
Los PAEA son más caros por el coste de los electrodos y los auriculares y por requerir mayor tiempo para su realización [141], aunque el coste se iguala al incluir el gasto de los casos derivados, pues la tasa de derivación es mayor con las EOA.
ANEXO IV. DIRECCIONES DE INTERNET
Pruebas y protocolos de cribado:
Selección de estudios recientes sobre hipoacusia neonatal y cribado auditivo:
Estudio LOCHI:
Programa de cribado auditivo neonatal del Reino Unido:
Información de los CDC sobre hipoacusia en niños, en inglés y español:
Web con versión en español que ofrece documentación sobre el cribado y la hipoacusia y es de utilidad para resolver las dudas de las familias:
Etapas del desarrollo de la audición y la comunicación del bebé (NIH):
Federación Española de Familias de Personas Sordas:
Federaciones y Asociaciones integradas en FIAPAS, por comunidades autónomas y provincias:
BIBLIOGRAFÍA
- Morton CC, Nance WE. Newborn Hearing Screening — A Silent Revolution. N Engl J Med. 2006;354:2151–64.
- Leigh G, Schmulian-Taljaard D, Poulakis Z. Newborn Hearing Screening. En: Discroll CJ, McPherson B, editors. Newborn Screening Systems. The Complete Perspective. San Diego, CA: Plural Publishing, Inc; 2010. p. 95–116.
- Tomblin JB, Harrison M, Ambrose SE, Walker EA, Oleson JJ, Moeller MP. Language Outcomes in Young Children with Mild to Severe Hearing Loss HHS Public Access. Ear Hear. 2015;36:76–91.
- Martin JAM, Bentzen O, Colley JRT, Hennebert D, Holm C, Iurato S, et al. Childhood deafness in the European Community. Scand Audiol. 1981;10:165–74.
- Early Identification of Hearing Impairment in Infants and Young Children. NIH Consens Statement Online [Internet]. 1993 [consultado 10 abr 2017]. Disponible en: https://consensus.nih.gov/1993/1993hearinginfantschildren092html.htm.
- Harrison M, Roush J. Age of suspicion, identification, and intervention for infants and young children with hearing loss: a national study. Ear Hear. 1996;17:55–62.
- Davis A, Bamford J, Wilson I, Ramkalawan T, Forshaw M, Wright S. A critical review of the role of neonatal hearing screening in the detection of congenital hearing impairment. Health Technol. Assess. (Rockv). 1997;1:i–iv, 1-176.
- Meadow-Orlans KP, Mertens DM, Sass-Lehrer MA, Scott-Olson K. Support services for parents and their children who are deaf or hard of hearing. A national survey. Am Ann Deaf. 1997;142:278–88.
- Van Naarden K, Decouflé P, Caldwell K. Prevalence and characteristics of children with serious hearing impairment in metropolitan Atlanta, 1991-1993. Pediatrics. 1999;103:570–5.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen. Neonatal screening for early detection of hearing impairment. IQWiG Reports - Comm. No. S05-01 2007;1–11.
- Joint Committee on Infant Hearing, American Academy of Audiology, American Academy of Pediatrics, American Speech-Language-Hearing Association, Directors of Speech and Hearing Programs in State Health and Welfare Agencies. Year 2000 position statement: principles and guidelines for early hearing detection and intervention programs. Pediatrics. 2000;106:798–817.
- Fitzpatrick EM, Whittingham J, Durieux-Smith A. Mild bilateral and unilateral hearing loss in childhood: a 20-year view of hearing characteristics, and audiologic practices before and after newborn hearing screening. Ear Hear. 2014;35:10–8.
- Nelson HD, Bougatsos C, Nygren P. Universal Newborn Hearing Screening: Systematic Review to Update the 2001 US Preventive Services Task Force Recommendation. Evidence Syntesis No 62. AHRQ Publication No. 08-05117-EF-1. Rockville, Maryland: Agency for Healthcare Research and Quality (US); 2008.
- Wolff R, Hommerich J, Riemsma R, Antes G, Lange S, Kleijnen J. Hearing screening in newborns: systematic review of accuracy, effectiveness, and effects of interventions after screening. Arch Dis Child. 2010;95:130–5.
- Pimperton H, Kennedy CR. The impact of early identification of permanent childhood hearing impairment on speech and language outcomes. Arch Dis Child. 2012;97:648–53.
- Insitute of Health Economics. The Safety and Efficacy/Effectiveness of Using Automated Testing Devices for Universal Newborn Hearing Screening: An Update. Edmonton AB: Institute of Health Economics; 2012.
- Yoshinaga-Itano C, Sedey AL, Coulter DK, Mehl AL. Language of early- and later-identified children with hearing loss. Pediatrics. 1998;102:1161–71.
- Yoshinaga-Itano C, Coulter D, Thomson V. The Colorado Newborn Hearing Screening Project: effects on speech and language development for children with hearing loss. J Perinatol. 2000;20:S132-7.
- Moeller MP. Early intervention and language development in children who are deaf and hard of hearing. Pediatrics. 2000;106:E43.
- Helfand M, Thompson DC, Davis R, McPhillips H, Homer CJ, Lieu TL. Newborn Hearing Screening: Systematic Evidence Review. Rockville (MD): Agency for Healthcare Research and Quality (US); 2001.
- WHO | Grades of hearing impairment [Internet]. WHO2016 [consultado 8 abr 2017]. Disponible en: http://www.who.int/pbd/deafness/hearing_impairment_grades/en.
- BIAP - Bureau International d’Audiophonologie - Recomendaciones CT 02 Classification des déficiences auditives [Internet]. [consultado 8 abr 2017]. Disponible en: http://www.biap.org/es/recommandations/recomendaciones/ct-02-clasificac….
- Mehl AL, Thomson V. The Colorado Newborn Hearing Screening Project, 1992-1999: On the Threshold of Effective Population-Based Universal Newborn Hearing Screening. Pediatrics. 2002;109:e7.
- Davis A, Wood S. The epidemiology of childhood hearing impairment: factor relevant to planning of services. Br J Audiol. 1992;26:77–90.
- Mauk G, Behrens T. Historical, Political, and Technological Context Associated with Early Identification of Hearing Loss. Semin Hear. 1993;14:1–17.
- Fortnum H, Davis A. Epidemiology of permanent childhood hearing impairment in Trent Region, 1985-1993. Br J Audiol. 1997;31:409–46.
- Vohr BR, Carty LM, Moore PE, Letourneau K. The Rhode Island hearing assessment program: Experience with statewide hearing screening (1993-1996). J Pediatr. 1998;133:353–7.
- Kennedy CR, McCann DC, Campbell MJ, Law CM, Mullee M, Petrou S, et al. Language ability after early detection of permanent childhood hearing impairment. N Engl J Med. 2006;354:2131–41.
- Korver AMH, Konings S, Dekker FW, Beers M, Wever CC, Frijns JHM, et al. Newborn hearing screening vs later hearing screening and developmental outcomes in children with permanent childhood hearing impairment. JAMA. 2010;304:1701–8.
- Wood SA, Sutton GJ, Davis AC. Performance and characteristics of the Newborn Hearing Screening Programme in England: The first seven years. Int J Audiol. 2015;54:353–8.
- Manrique M, Morera C, Moro M. Detección precoz de la hipoacusia infantil en recién nacidos de alto riesgo. Estudio multicéntrico. An Esp Pediatr. 1994;40:11–45.
- González de Aledo Linos A, Bonilla Miera C, Morales Angulo C, Gómez da Casa F, Barrasa Benito J. Cribado universal de la hipoacusia congénita en Cantabria: resultados de los dos primeros años. An. Pediatr (Barc). 2005;62:135–40.
- Hyde ML. Principles and Methods of Newborn Hearing Screening. En: Tharpe A, Seewald R, editors. Comprehensive handbook of pediatric audiology. San Diego, CA: Plural Publishing, Inc.; 2017.
- Grandori F. European Consensus Statement on Neonatal Hearing Screening. Finalized at the European Consensus Development Conference on Neonatal Hearing Screening. Milan, 15-16 May 1998. Acta Paediatr. 1999;88:107–8.
- Chu K, Elimian A, Barbera J, Ogburn P, Spitzer A, Quirk JG. Antecedents of newborn hearing loss. Obstet Gynecol. 2003;101:584–8.
- Yoshinaga-Itano C, Gravel JS. The evidence for universal newborn hearing screening. Am J Audiol. 2001;10:62–4.
- Durieux-Smith A, Fitzpatrick E, Whittingham J. Universal newborn hearing screening: a question of evidence. Int J Audiol. 2008;47:1–10.
- Uus K, Bamford J. Effectiveness of population-based newborn hearing screening in England: ages of interventions and profile of cases. Pediatrics. 2006;117:e887-93.
- Vos B, Senterre C, Lagasse R, Levêque A. Newborn hearing screening programme in Belgium: a consensus recommendation on risk factors. BMC Pediatr. 2015;15:160.
- Bielecki I, Horbulewicz A, Wolan T. Risk factors associated with hearing loss in infants: an analysis of 5282 referred neonates. Int J Pediatr Otorhinolaryngol. 2011;75:925–30.
- Vohr BR. Screening the newborn for hearing loss. UpToDate. Waltham, MA: UpToDate Inc. http://www.uptodate.com (consultado 18 mar 2018).
- Davis A, Davis K. Descriptive epidemiology of childhood hearing impairment. En: Tharpe A, Seewald R, editors. Comprehensive handbook of pediatric audiology. San Diego, CA: Plural Publishing, Inc.; 2017.
- Moeller MP. Current State of Knowledge: Psychosocial Development in Children with Hearing Impairment. Ear Hear. 2007;28:729–39.
- Moeller MP, Tomblin JB, Yoshinaga-Itano C, Connor CM, Jerger S. Current State of Knowledge: Language and Literacy of Children with Hearing Impairment. Ear Hear. 2007;28:740–53.
- Luckner JL, Cooke C. A summary of the vocabulary research with students who are deaf or hard of hearing. Am Ann Deaf. 2010;155:38–67.
- Torres Monreal S, Santana Hernández R. Reading levels of Spanish deaf students. Am Ann Deaf. 2005;150:379–87.
- Marco J, Matéu S, coordinadores. Libro blanco sobre hipoacusia. Detección precoz de la hipoacusia en recién nacidos. Madrid: Ministerio de Sanidad y Consumo, CODEPEH; 2003.
- Cupples L, Ching TYC, Crowe K, Seeto M, Leigh G, Street L, et al. Outcomes of 3-year-old children with hearing loss and different types of additional disabilities. J Deaf Stud Deaf Educ. 2014;19:20–39.
- Esparza Olcina MJ, Colomer Revuelta J, Martínez Rubio A, Ma Mengual Gil J, Merino Moína M, Rosa Pallás Alonso C, et al. El marco analítico en la elaboración de recomendaciones del USPSTF. Rev Pediatr Aten Primaria. 2017;19:177–82.
- Pimperton H, Kreppner J, Mahon M, Stevenson J, Terlektsi E, Worsfold S, et al. Language Outcomes in Deaf or Hard of Hearing Teenagers Who Are Spoken Language Users: Effects of Universal Newborn Hearing Screening and Early Confirmation. Ear Hear. 2017;38:598–610.
- McCann DC, Worsfold S, Law CM, Mullee M, Petrou S, Stevenson J, et al. Reading and communication skills after universal newborn screening for permanent childhood hearing impairment. Arch Dis Child. 2009;94:293–7.
- Pimperton H, Blythe H, Kreppner J, Mahon M, Peacock JL, Stevenson J, et al. The impact of universal newborn hearing screening on long-term literacy outcomes: a prospective cohort study. Arch Dis Child. 2016;101:9–15.
- Wake M, Ching TYC, Wirth K, Poulakis Z, Mensah FK, Gold L, et al. Population Outcomes of Three Approaches to Detection of Congenital Hearing Loss. Pediatrics. 2016;137:1–10.
- Ching TYC, Dillon H, Button L, Seeto M, Van Buynder P, Marnane V, et al. Age at Intervention for Permanent Hearing Loss and 5-Year Language Outcomes. Pediatrics. 2017;140:e20164274.
- Fitzpatrick E, Durieux-Smith A, Eriks-Brophy A, Olds J, Gaines R. The impact of newborn hearing screening on communication development. J Med Screen. 2007;14:123–31.
- Mason JA, Herrmann KR. Universal infant hearing screening by automated auditory brainstem response measurement. Pediatrics. 1998;101:221–8.
- Akinpelu O V, Peleva E, Funnell WRJ, Daniel SJ. Otoacoustic emissions in newborn hearing screening: a systematic review of the effects of different protocols on test outcomes. Int J Pediatr Otorhinolaryngol. 2014;78:711–7.
- Norton SJ, Gorga MP, Widen JE, Folsom RC, Sininger Y, Cone-Wesson B, et al. Identification of neonatal hearing impairment: evaluation of transient evoked otoacoustic emission, distortion product otoacoustic emission, and auditory brain stem response test performance. Ear Hear. 2000;21:508–28.
- American Academy of Pediatrics, Joint Committee on Infant Hearing. Year 2007 position statement: Principles and guidelines for early hearing detection and intervention programs. Pediatrics. 2007;120:898–921.
- Caluraud S, Marcolla-Bouchetemblé A, de Barros A, Moreau-Lenoir F, de Sevin E, Rerolle S, et al. Newborn hearing screening: Analysis and outcomes after 100,000 births in Upper-Normandy French region. Int J Pediatr Otorhinolaryngol. 2015;79:829–33.
- Gravel JS, White KR, Johnson JL, Widen JE, Vohr BR, James M, et al. A multisite study to examine the efficacy of the otoacoustic emission/automated auditory brainstem response newborn hearing screening protocol: recommendations for policy, practice, and research. Am J Audiol. 2005;14:S217-28.
- Wessex Universal Neonatal Hearing Screening Trial Group. Controlled trial of universal neonatal screening for early identification of permanent childhood hearing impairment. Lancet. 1998;352:1957–64.
- Kennedy C, McCann D, Campbell MJ, Kimm L, Thornton R. Universal newborn screening for permanent childhood hearing impairment: an 8-year follow-up of a controlled trial. Lancet. 2005;366:660–2.
- Korver AMH, Konings S, Meuwese-Jongejeugd A, van Straaten HLM, Uilenburg N, Dekker FW, et al. National study of newborn hearing screening: programme sensitivity and characteristics of undetected children. B-ENT. 2013;Suppl 21:37–44.
- Dalzell L, Orlando M, MacDonald M, Berg A, Bradley M, Cacace A, et al. The New York State universal newborn hearing screening demonstration project: ages of hearing loss identification, hearing aid fitting, and enrollment in early intervention. Ear Hear. 2000;21:118–30.
- Connolly JL, Carron JD, Roark SD. Universal newborn hearing screening: are we achieving the Joint Committee on Infant Hearing (JCIH) objectives? Laryngoscope. 2005;115:232–6.
- Weichbold V, Nekahm-Heis D, Welzl-Mueller K. Ten-year outcome of newborn hearing screening in Austria. Int J Pediatr Otorhinolaryngol. 2006;70:235–40.
- Szyfter W, Greczka G, Dąbrowski P, Wróbel M. The report on the Universal Neonatal Hearing Screening Program in Poland between 2003 and 2015. Otolaryngol Pol. 2016;70:1–5.
- Molini E, Calzolaro L, Lapenna R, Ricci G. Universal newborn hearing screening in Umbria region, Italy. Int J Pediatr Otorhinolaryngol. 2016;82:92–7.
- Bailey HD, Bower C, Krishnaswamy J, Coates HL. Newborn hearing screening in Western Australia. Med J Aust. 2002;177:180–5.
- Joseph R, Tan HKK, Low KT, Ng PG, Tunnel J, Mathew S. Mass newborn screening for hearing impairment. Southeast Asian J Trop Med Public Health. 2003;34 Suppl 3:229–30.
- Harrison M, Roush J, Wallace J. Trends in age of identification and intervention in infants with hearing loss. Ear Hear. 2003;24:89–95.
- Sininger YS, Martinez A, Eisenberg L, Christensen E, Grimes A, Hu J. Newborn hearing screening speeds diagnosis and access to intervention by 20-25 months. J Am Acad Audiol. 2009;20:49–57.
- Worsfold S, Mahon M, Yuen HM, Kennedy C. Narrative skills following early confirmation of permanent childhood hearing impairment. Dev Med Child Neurol. 2010;52:922–8.
- Wake M, Poulakis Z, Hughes EK, Carey-Sargeant C, Rickards FW. Hearing impairment: a population study of age at diagnosis, severity, and language outcomes at 7-8 years. Arch Dis Child. 2005;90:238–44.
- Ching TYC, Leigh G, Dillon H. Introduction to the longitudinal outcomes of children with hearing impairment (LOCHI) study: background, design, sample characteristics. Int J Audiol. 2013;52 Suppl 2:S4-9.
- Ching TYC, Dillon H, Marnane V, Hou S, Day J, Seeto M, et al. Outcomes of early- and late-identified children at 3 years of age: findings from a prospective population-based study. Ear Hear. 2013;34:535–52.
- Ching TYC, Dillon H. Major findings of the LOCHI study on children at 3 years of age and implications for audiological management. Int J Audiol. 2013;52 Suppl 2:S65-8.
- Cupples L, Ching TYC, Crowe K, Day J, Seeto M. Predictors of Early Reading Skill in 5-Year-Old Children With Hearing Loss Who Use Spoken Language. Read Res Q. 2014;49:85–104.
- Cupples L, Ching TYC, Button L, Leigh G, Marnane V, Whitfield J, et al. Language and speech outcomes of children with hearing loss and additional disabilities: identifying the variables that influence performance at five years of age. Int J Audiol 2016;1–12.
- Lammers MJW, Jansen TTG, Grolman W, Lenarz T, Versnel H, van Zanten GA, et al. The influence of newborn hearing screening on the age at cochlear implantation in children. Laryngoscope. 2015;125:985–90.
- Forli F, Arslan E, Bellelli S, Burdo S, Mancini P, Martini A, et al. Systematic review of the literature on the clinical effectiveness of the cochlear implant procedure in paediatric patients. Acta Otorhinolaryngol Ital. 2011;31:281–98.
- Monteiro CG, Cordeiro AA, Silva HJ, Queiroga BA. Children’s language development after cochlear implantation: a literature review. Codas. 2016;28:319–25.
- Bruijnzeel H, Ziylan F, Stegeman I, opsakal V, Grolman W. A Systematic Review to Define the Speech and Language Benefit of Early (<12 Months) Pediatric Cochlear Implantation. Audiol Neurotol. 2016;21:113–26.
- Levine D, Strother-Garcia K, Golinkoff RM, Hirsh-Pasek K. Language Development in the First Year of Life: What Deaf Children Might Be Missing Before Cochlear Implantation. Otol Neurotol. 2016;37:e56-62.
- Dettman SJ, Dowell RC, Choo D, Arnott W, Abrahams Y, Davis A, et al. Long-term Communication Outcomes for Children Receiving Cochlear Implants Younger Than 12 Months: A Multicenter Study. Otol Neurotol. 2016;37:e82-95.
- Nelson HD, Bougatsos C, Nygren P. Universal newborn hearing screening: systematic review to update the 2001 US Preventive Services Task Force Recommendation. Pediatrics. 2008;122:e266-76.
- Ravi R, Gunjawate DR, Yerraguntla K, Rajashekhar B, Lewis LE. Knowledge and attitude of parents/caregivers towards hearing loss and screening in newborns - a systematic review. Int J Audiol. 2016;55:715–22.
- Kennedy CR. Controlled trial of universal neonatal screening for early identification of permanent childhood hearing impairment: coverage, positive predictive value, effect on mothers and incremental yield. Wessex Universal Neonatal Screening Trial Group. Acta Paediatr Suppl. 1999;88:73–5.
- Weichbold V, Welzl-Mueller K. Maternal concern about positive test results in universal newborn hearing screening. Pediatrics. 2001;108:1111–6.
- Poulakis Z, Barker M, Wake M. Six month impact of false positives in an Australian infant hearing screening programme. Arch Dis Child. 2003;88:20–4.
- Daneshi A, Ajalloueyan M, Ghasemi MM, Hashemi BS, Emamjome H, Farhadi M, et al. Complications in a series of 4400 paediatric cochlear implantation. Int J Pediatr Otorhinolaryngol. 2015;79:1401–3.
- O’Connell BP, Holcomb MA, Morrison D, Meyer TA, White DR. Safety of cochlear implantation before 12 months of age: Medical University of South Carolina and Pediatric American College of Surgeons-National Surgical Quality improvement program outcomes. Laryngoscope. 2016;126:707–12.
- Farinetti A, Ben Gharbia D, Mancini J, Roman S, Nicollas R, Triglia J-M. Cochlear implant complications in 403 patients: Comparative study of adults and children and review of the literature. Eur. Ann. Otorhinolaryngol. Head Neck Dis. 2014;131:177–82.
- Theunisse HJ, Mulder JJ, Pennings RJE, Kunst HPM, Mylanus EAM. A database system for the registration of complications and failures in cochlear implant surgery applied to over 1000 implantations performed in Nijmegen, The Netherlands. J Laryngol Otol. 2014;128:952–7.
- Incesulu A, Vural M, Erkam U. Children with cochlear implants: parental perspective. Otol Neurotol. 2003;24:605–11.
- Williams TR, Alam S, Gaffney M, Centers for Disease Control and Prevention (CDC). Progress in identifying infants with hearing loss—United States, 2006-2012. MMWR Morb Mortal Wkly Rep. 2015;64:351–6.
- Uus K, Bamford J, Taylor R. An analysis of the costs of implementing the National Newborn Hearing Screening Programme in England. J Med Screen. 2006;13:14–9.
- Colgan S, Gold L, Wirth K, Ching T, Poulakis Z, Rickards F, et al. The cost-effectiveness of universal newborn screening for bilateral permanent congenital hearing impairment: systematic review. Acad Pediatr. 2012;12:171–80.
- Keren R, Helfand M, Homer C, McPhillips H, Lieu TA. Projected cost-effectiveness of statewide universal newborn hearing screening. Pediatrics. 2002;110:855–64.
- Ridao López M, Gavín Benavent P, Martín Sánchez J, Bernal Delgado E. Programa de actividades de detección precoz de problemas de salud entre los 0 y 14 años. Efectividad, seguridad y evaluación económica de las diferentes alternativas existentes en la detección precoz de la hipoacusia en la edad pediátrica. Ministerio de Sanidad, Sevicios Sociales e Igualdad. Insitiuto Aragonés de Ciencias de la Salud; 2016. Informes de evaluación de tecnologías Sanitarias: IACS.
- Baños-Álvarez E, Rosario-Lozano MP. Cribado neonatal de hipoacusia. Informe de respuesta breve. Sevilla: Agencia de Evaluación de Tecnologías Sanitarias de Andalucía (AETSA); 2017.
- Liming BJ, Carter J, Cheng A, Choo D, Curotta J, Carvalho D, et al. International Pediatric Otolaryngology Group (IPOG) consensus recommendations: Hearing loss in the pediatric patient. Int J Pediatr Otorhinolaryngol. 2016;90:251–8.
- Vos B, Senterre C, Lagasse R, Tognola G, Levêque A. Organisation of newborn hearing screening programmes in the European Union: widely implemented, differently performed. Eur J Public Health. 2016;26:505–10.
- Trinidad-Ramos G, de Aguilar VA, Jaudenes-Casaubon C, Nunez-Batalla F, Sequi-Canet JM. Recomendaciones de la Comisión para la Detección Precoz de la Hipoacusia (CODEPEH) para 2010. Acta Otorrinolaringol Esp. 2010;61:69–77.
- Benito-Orejas JI, Ramírez B, Morais D, Almaraz A, Fernández-Calvo JL. Comparison of two-step transient evoked otoacoustic emissions (TEOAE) and automated auditory brainstem response (AABR) for universal newborn hearing screening programs. Int J Pediatr Otorhinolaryngol. 2008;72:1193–201.
- Granell J, Gavilanes J, Herrero J, Sánchez-Jara JL, Velasco MJ, Martín G. Cribado universal de la hipoacusia neonatal: ¿Es más eficiente con potenciales evocados auditivos que con emisiones otoacústicas? Acta Otorrinolaringol Esp. 2008;59:170–5.
- Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad y Consumo. Programa de detección precoz de la hipoacusia [Internet]. 2003. [consultado 10 dic 2017]. Disponible en: https://www.msssi.gob.es/profesionales/saludPublica/prevPromocion/mater….
- Cubillana-Herrero JD, Pelegrín-Hernández JP, Soler-Valcarcel A, Mínguez-Merlos N, Cubillana-Martínez MJ, Navarro Barrios Á, et al. The assessment of the Newborn Hearing Screening Program in the Region of Murcia from 2004 to 2012. Int J Pediatr Otorhinolaryngol. 2016;88:228–32.
- Dirección General de Salud pública - Consejería de Sanidad del Principado de Asturias. Programa de atención al déficit auditivo infantil 2002-2014 [Internet]. 2015. [consultado 18 dic 2017]. Disponible en: https://www.astursalud.es/noticias/-/noticias/programa-de-atencion-al-d….
- Xunta de Galicia - Consellería de Sanidade - Dirección Xeral de Saúde Pública. Programa galego para a detección da xordeira en período neonatal (PGDXPN). Resultados 2002-2016 [Internet]. 2016. [consultado 18 dic 2017]. Disponible en: https://www.sergas.es/Saude-publica/Programa-de-detección-precoz-da-hip….
- Consejería de Sanidad de la Comunidad de Madrid. Resultados del cribado neonatal – Año 2013. [Internet]. 2013 [consultado 30 abr 2017]. Disponible en: http://www.madrid.org/cs/Satellite?cid=1142703093052&language=es&pagena….
- Ravi R, Gunjawate DR, Yerraguntla K, Lewis LE, Driscoll C, Rajashekhar B. Follow-up in newborn hearing screening – A systematic review. Int J Pediatr Otorhinolaryngol. 2016;90:29–36.
- NHS screening programmes: national data reporting - GOV.UK [Internet]. [consultado 2 may 2017], Disponible en: https://www.gov.uk/government/collections/nhs-screening-programmes-nati….
- EHDI Annual Data | Hearing Loss | NCBDDD | CDC [Internet]. [conultado 2 may 2017]. Disponible en: https://www.cdc.gov/ncbddd/hearingloss/ehdi-data.html.
- Molloy C, Wake M, Poulakis Z, Barker M, Goldfeld S. Models for screening and surveillance of hearing in early childhood: Identification and review of evidence and efficiency [Internet]. 2014. [consultado 10 abr 2017]. Disponible en: http://www.health.nsw.gov.au/kidsfamilies/MCFhealth/Documents/models-fo….
- Adebanjo T, Godfred-Cato S, Viens L et al. Update: Interim Guidance for the Diagnosis, Evaluation, and Management of Infants with Possible Congenital Zika Virus Infection — United States, October 2017. MMWR Morb Mortal Wkly Rep. 2017;66:1089–99.
- Beswick R, Driscoll C, Kei J, Glennon S. Monitoring for postnatal hearing loss using risk factors: a systematic literature review. Ear Hear. 2012;33:745–56.
- Wood SA, Davis AC, Sutton GJ. Effectiveness of targeted surveillance to identify moderate to profound permanent childhood hearing impairment in babies with risk factors who pass newborn screening. Int J Audiol. 2013;52:394–9.
- Newborn hearing screening programme (NHSP) operational guidance - GOV.UK [Internet]. [consultado 10 mar 2018]. Disponible en: https://www.gov.uk/government/publications/newborn-hearing-screening-pr….
- Beswick R, Driscoll C, Kei J, Glennon S. Targeted surveillance for postnatal hearing loss: A program evaluation. Int J Pediatr Otorhinolaryngol. 2012;76:1046–56.
- Beswick R, Driscoll C, Kei J, Khan A, Glennon S. Which risk factors predict postnatal hearing loss in children? J Am Acad Audiol. 2013;24:205–13.
- Driscoll C, Beswick R, Doherty E, D’Silva R, Cross A. The validity of family history as a risk factor in pediatric hearing loss. Int J Pediatr Otorhinolaryngol. 2015;79:654–9.
- Beswick R, Driscoll C, Kei J, Glennon S. Reccomendations for monitoring hearing in children using a risk factor registry. J Hear Sci. 2012;2:57–65.
- Dumanch KA, Holte L, O’Hollearn T, Walker E, Clark J, Oleson J. High Risk Factors Associated With Early Childhood Hearing Loss: A 3-Year Review. Am J Audiol. 2017;26:129-42.
- Halloran D, Wall T, Evans H, Hardin J, Woolley A. Hearing screening at well-child visits. Arch Pediatr Adolesc Med. 2005;159:949–55.
- Fortnum H, Ukoumunne OC, Hyde C, Taylor RS, Ozolins M, Errington S, et al. A programme of studies including assessment of diagnostic accuracy of school hearing screening tests and a cost-effectiveness model of school entry hearing screening programmes. Health Technol Assess. 2016;20(36).
- Fort M. Newborn Hearing Screening: Making a Difference. N C Med J. 2017;78:96–100.
- Gilliver M, Ching TYC, Sjahalam-King J. When expectation meets experience: parents’ recollections of and experiences with a child diagnosed with hearing loss soon after birth. Int J Audiol. 2013;52 Suppl 2:S10-6.
- US Preventive Services Task Force. Universal screening for hearing loss in newborns: US Preventive Services Task Force recommendation statement. Pediatrics. 2008;122:143–8.
- Patel H, Feldman M. Universal newborn hearing screening. Paediatr Child Health. 2011;16:301–10.
- Germeinsamer Bundesausschuss. Early detection of diseases in children - Federal Joint Committee [Internet]. [consultado 24 abr 2017]. Disponible en: http://www.english.g-ba.de/special-topics/prevention/children.
- World Health Organization (WHO). Newborn and infant hearing screening: current issues and guiding principles for action. Geneva: World Health Organization; 2010.
- UK National Screening Committee. Hearing (newborn) [Internet]. 2006 [consultado 26 mar 2017]. Disponible en: http://legacy.screening.nhs.uk/hearing-newborn.
- Australian Government Department of Health and Ageing. National Framework for Neonatal Hearing Screening [Internet]. [consultado 24 abr 2017]. Disponible en: http://www.health.gov.au/internet/main/publishing.nsf/Content/neonatal-….
- Bakhos D, Marx M, Villeneuve A, Lescanne E, Kim S, Robier A. Electrophysiological exploration of hearing. Eur Ann Otorhinolaryngol Head Neck Dis. 2017;134:325–31.
- Berg AL, Prieve BA, Serpanos YC, Wheaton MA, Association AS-L-H, American Academy of Pediatrics JC on IH, et al. Hearing screening in a well-infant nursery: profile of automated ABR-fail/OAE-pass. Pediatrics. 2011;127:269–75.
- Korver AMH, van Zanten GA, Meuwese-Jongejeugd A, van Straaten HLM, Oudesluys-Murphy AM. Auditory neuropathy in a low-risk population: a review of the literature. Int J Pediatr Otorhinolaryngol. 2012;76:1708–11.
- Boudewyns A, Declau F, van den Ende J, Hofkens A, Dirckx S, Van de Heyning P. Auditory neuropathy spectrum disorder (ANSD) in referrals from neonatal hearing screening at a well-baby clinic. Eur J. Pediatr. 2016;175:993–1000.
- Wroblewska-Seniuk KE, Dabrowski P, Szyfter W, Mazela J. Universal newborn hearing screening: methods and results, obstacles, and benefits. Pediatr Res. 2017;81:415–22.
- American Speech-Language Hearing Association. Newborn Infant Hearing Screening: Key Issues [Internet]. [cited 2017 Apr 22];Available from: http://www.asha.org/PRPSpecificTopic.aspx?folderid=8589935234§ion=K….
El autor declara que no tiene conflictos de intereses en relación con el tema abordado en este documento.
Cómo citar este artículo: García Aguado, J. Cribado de la hipoacusia. En Recomendaciones PrevInfad/PAPPS [en línea]. Actualizado mayo de 2018. [consultado DD-MM-AAAA]. Disponible en http://previnfad.aepap.org/monografia/hipoacusia