ÍNDICE
Además de ser esencial para el transporte de oxígeno, el hierro es también componente estructural de muchas enzimas que lo hacen indispensable para una amplia gama de procesos metabólicos, tales como actividad fagocítica antimicrobiana, síntesis de neurotransmisores, síntesis de ADN o la respiración celular.
La mayor parte del hierro corporal es reutilizado; los adultos incorporan 1-2 mg de hierro al día procedente de la dieta. En los niños preescolares las necesidades son mayores (7mg al día). La absorción duodenal supone un complejo proceso, regulado entre otros por la hepcidina.
En el déficit de hierro hay tres etapas sucesivas: a) ferropenia latente: disminución del hierro corporal (siendo la médula ósea el último compartimento en deplecionarse) b) ferropenia sin anemia o eritropoyesis ineficaz: empieza a haber modificación de las características de los hematíes y c) anemia ferropénica: disminución de hemoglobina.
El sistema nervioso presentará deficiencia férrica antes de la aparición de la anemia, debido a la priorización de la eritropoyesis sobre otros órganos.
El hierro es crucial para el desarrollo cerebral. El neurodesarrollo comienza en la época fetal y persiste durante la infancia, siendo máxima su velocidad en los primeros años de la vida. El cerebro humano casi triplica su peso desde el nacimiento a los tres años; a esa edad ha alcanzado el 85% del peso adulto. Modelos animales han demostrado déficits en mielinización, sinaptogénesis y síntesis de neurotransmisores en caso de ferropenia fetal y durante los primeros meses postnatales. De hecho, se describen déficits cognitivos, motores, sensoriales, socioemocionales o de conducta en niños ferropénicos, algunos de los cuales pueden persistir a largo plazo; la ferropenia puede ser considerada además de un déficit nutricional, un factor de riesgo neurológico.
Aunque las consecuencias clínicas no están del todo claras, ni tampoco el efecto que la suplementación férrica podría ejercer en el riesgo infeccioso (como por ejemplo en áreas endémicas de paludismo), el hierro es un cofactor enzimático para la erradicación de patógenos, y en vitro es modulador de la actividad linfocítica.
Dada la importancia del micronutriente, cuyo déficit en la mayoría de las ocasiones es asintomático, y que en el caso de no tratarse puede, además de conducir a anemia, tener consecuencias en el desarrollo infantil a corto y medio plazo, se propone la revisión de las evidencias disponibles en relación con el cribado de la ferropenia en niños menores de cinco años. Tomamos como marco el documento previo del grupo PrevInfad, con revisión de la bibliografía posterior a este.
La ferropenia es el déficit nutricional más frecuente en la infancia. La Organización Mundial de la Salud (OMS) (1) estima que el 43% de los niños del planeta están anémicos, y de ellos el 42% es por déficit de hierro. La anemia es especialmente prevalente en el centro y oeste de África y en el sur de Asia. En Estados Unidos se calcula que un 15% de los niños de entre 1 y 3 años tiene déficit férrico y que más de un cinco por ciento tienen anemia ferropénica. En Europa (2) los niños de entre 3 y 36 meses tuvieron prevalencias dispares: cercanas al 50% en países del este, y por debajo de un 5% en la Europa Occidental.
En España (3), un estudio transversal llevado a cabo en Almería (2020) incluyendo 951 niños entre 1 y 11 años, encontró una prevalencia de ferropenia de un 7,7% y de anemia ferropénica de 0,9%. El análisis multivariante identificó como factores independientes de riesgo: menores de cinco años con una prevalencia de ferropenia de 8,7% (Odds ratio [OR]: 2,2; intervalo de confianza del 95% [IC 95%]: 1,35–3,6); consumo excesivo de leche de vaca y productos lácteos (OR: 1,87; IC 95%: 1,13–3,1) y pobre ingesta de verduras (OR: 2,7; IC 95%: 1,2–6,1).
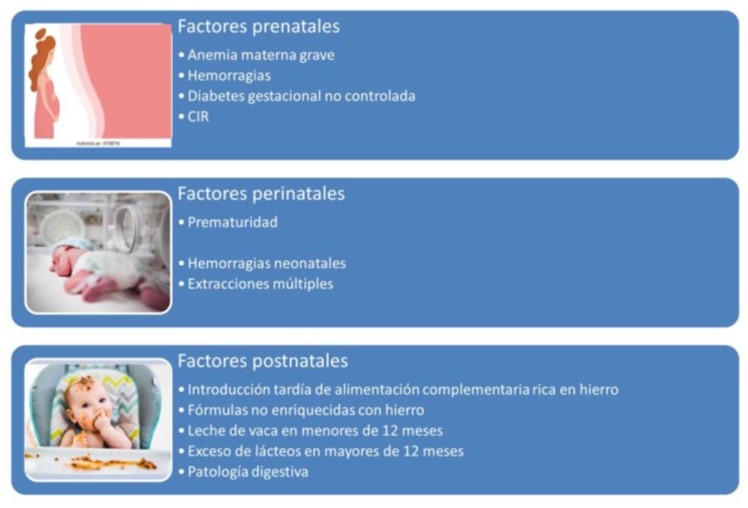
Los factores de riesgo de ferropenia (4) incluyen factores prenatales (anemia ferropénica materna grave, diabetes materna, crecimiento intrauterino retardado) neonatales (prematuridad, hemorragias) y durante la lactancia (ausencia de alimentación complementaria en mayores de seis meses, exceso de lácteos, enfermedades malabsortivas).
Los efectos deletéreos del déficit férrico parecen ser más intensos en función de la intensidad, la duración y la precocidad de este (5, 6). Además del efecto que pueda llevar la anemia, la falta de hierro por sí sola es capaz de producir efectos negativos sobre el desarrollo cerebral; modelos preclínicos hablan de períodos sensibles y mecanismos epigenéticos hierro-sensibles, responsables no solo de trastornos del neurodesarrollo, sino de efectos que aparecerían en la edad adulta en forma de trastornos de salud mental (7, 8).
Por tanto, sería deseable la prevención primaria (9). De ahí que se estudien el efecto de suplementos maternos (10-12) o de camplaje tardío de cordón sobre el neurodesarrollo (13-15). En cuanto al manejo de la embarazada, parece indicado el cribado de su nivel férrico, y el camplaje tardío de cordón ha demostrado mejoras en los parámetros hematológicos inmediatos del recién nacido, aunque los resultados neurológicos a medio y largo plazo no son concluyentes (16).
La lactancia materna (17, 18) y los suplementos férricos en prematuros siguen mostrando evidencia de mejoras en resultados en salud (19, 20).
Conocidos los posibles factores de riesgo y factores protectores, y teniendo en cuenta que en la mayoría de las ocasiones la ferropenia es asintomática, el planteamiento de un cribado en niños pequeños necesitará valorar medidas de detección, medidas terapéuticas y su efecto sobre los resultados en salud a corto, medio y largo plazo.
En cuanto a la eficacia de la terapia con hierro oral (sulfato ferroso) en la mejora de parámetros bioquímicos y hematológicos (21) y la escasez de efectos secundarios, el estudio Bestron es de referencia: el tratamiento durante 12 semanas mejoró los depósitos corporales de hierro y previno la aparición de anemia (22).
Se revisarán por tanto la actualización en medidas diagnósticas y resultados en salud.

Figura 1. Cribado de ferropenia en menores de cinco años: marco analítico.
(Adaptado del USPSTF con permiso).
1.-Hacer cribados de ferropenia en menores de cinco años ¿supone mejorar resultados en salud?: ¿mejora el crecimiento, el desarrollo cognitivo o el desarrollo psicomotor?
• No disponemos de estudios que evalúen la eficacia del cribado de ferropenia en niños asintomáticos sobre resultados en salud: mejoría de calidad de vida, mejoría somatometría, mejoría en el neurodesarrollo.
• Al no disponer de evidencia directa, se buscará respuesta a eslabones intermedios de la cadena.
2.-¿Disponemos de pruebas precisas para detectar ferropenia en menores de cinco años?
Las cifras de Hemoglobina y el Hematocrito definen la presencia o no de anemia, pero no proporcionan información de los depósitos de hierro. Microcitosis o hipocromía no son exclusivos de ferropenia. Índices eritrocitarios normales no excluyen ferropenia.
a) Nuevos índices de glóbulos rojos:
Contenido de Hemoglobina reticulocitaria: Se considera un medidor en tiempo real de ferropenia funcional. No es un reactante de fase aguda.
Un estudio alemán reciente lo plantea como una alternativa barata para ser usada como única prueba de cribado (23).
Pero también se altera en talasemia, y lo más importante es la variabilidad de punto de corte entre los distintos estudios (entre 25 y 33.5 pg). La Sociedad británica de Hematología plantea que mientras no estén claro los límites, cifras menores de 29 pg apoyarían el diagnóstico de ferropenia, si el resto de las pruebas no son concluyentes.
Porcentaje de células rojas hipocrómicas: Refleja el estado del hierro en los tres meses previos (24). Un valor superior al 5% sugiere ferropenia. Pero el recuento se ve afectado por el transporte, debiendo ser analizada la muestra en las 3 ó 4 horas tras la extracción.
b) Hierro
Hierro: Además de ser reactante de fase aguda, sus niveles varían incluso a lo largo del día, por lo que no es un útil para medir los depósitos férricos (22).
Saturación de transferrina: Dependiente del hierro sérico y de la capacidad de la transferrina de unirse a él, tiene mejor rendimiento diagnóstico que ambos parámetros por separado. Un índice disminuido apoyaría el diagnóstico de ferropenia si el resto de los datos no fueran concluyentes.
Receptor sérico de la transferrina: Derivado de la proteólisis del receptor de membrana, aumenta en caso de déficit férrico. No es un reactante de fase aguda. (25). Como inconvenientes: es caro, no siempre está disponible, no es precoz, y no disponemos de puntos de corte consensuados. No se recomienda para detectar ferropenia.
En estudio las ventajas que podrían ofrecer ciertos índices, como receptor sérico/ferritina y el índice logarítmico (26) : receptor sérico de transferrina/logaritmo de ferritina.
c) Nuevos parámetros:
Protoforfirina Znc: Aunque en los primeros estudios mostraba buena sensibilidad y especificidad (27, 28) no parece tener buen poder predictivo. Aumenta en caso de ferropenia, pero también lo hace en intoxicación por plomo y en anemias sideroblásticas (22). Esto, unido a su escasa disponibilidad, hace que no se pueda recomendar como prueba de cribado de ferropenia.
Eritroferrona: Hormona producida por los eritroblastos, aumenta la absorción y movilización del hierro, por lo que se eleva en caso de ferropenia. No establecido como parámetro clínico habitual (29).
Hepcidina: Hormona sintetizada en el hígado que se une específicamente a la ferroportina, proteína transmembrana expresada en las células que movilizan hierro; dicha unión inhibe la absorción intestinal del mismo y la liberación del almacenado en los macrófagos (25).
Niveles elevados en procesos inflamatorios (incluyendo obesidad) y disminuidos en caso de ferropenia (excepto en anemia ferropénica no respondedora genéticamente determinada).
Los métodos actuales de medición son específicos, pero poco sensibles, por lo que no se recomienda para la valoración de déficit férrico.
d) Ferritina
Marcador más precoz y específico de los depósitos corporales de hierro, con correlación demostrada con niveles de este en médula ósea (22).
Es un reactante de fase aguda, por lo que niveles normales o elevados no descartan ferropenia; niveles bajos son diagnósticos de deficiencia de hierro.
La Organización Mundial de la Salud (1) en el año 2020, recomienda el uso de la ferritina para el diagnóstico de ferropenia en individuos sanos (fuerte recomendación, aunque con baja certeza de evidencia). En función de la población, recomienda pedir al unísono reactantes de fase aguda y en caso de ser positivos, el punto de corte de normalidad sería 30 µg/l. En caso de ausencia de inflamación, niveles inferiores a 12 µg/l de ferritina serían diagnósticos de ferropenia en menores de 5 años, mientras que a partir de esa edad el punto de corte sería 15µg/l.
Pero no hay unanimidad en la recomendación de estos valores. Cochrane (30) en su revisión de 2021 afirma que la ferritina puede ser segura para diagnosticar ferropenia en individuos sintomáticos, pero que no se dispone de la suficiente robustez como para postular cifras diagnósticas en caso de ausencia de síntomas ni de sobredosis de hierro.
Con el objetivo de recomendar cifras basadas en fisiopatología y no en estudios poblacionales, en 2021 se publica un estudio relacionando las cifras de ferritina a partir de las cuales se empieza a modificar el receptor sérico de la transferrina y la hemoglobina, concluyendo que en niños la cifra adecuada sería 20 µg/l (31).
Un estudio canadiense (32) relacionó niveles de ferritina con función cognitiva en niños de 1 a 3 años, sugiriendo que puntos de corte entre 17 y 18 µg/l serían más adecuados que los postulados por la OMS, mientras que otros autores lo elevan a 24-25 µg/l en niños menores de un año (33).
Aunque puede que un margen de seguridad sugiriera alcanzar niveles más altos, los niveles aconsejados por la OMS son diagnósticos de ferropenia y son los preconizados por la Sociedad Británica de Hematología (34).
No quedan claro por tanto los niveles de ferritina adecuados para asegurar la normalidad de nivel de hierro en tejido cerebral.
3.-¿Cuáles serían los daños potenciales de cribar la ferropenia en menores de cinco años?
No se encontraron estudios diseñados para valorar los daños potenciales del cribado. Además de los inherentes a cualquier cribado masivo (ansiedad, falsos positivos, coste), sería deseable disponer de métodos no invasivos (35).
En relación a los métodos no invasivos, distintas técnicas en investigación son prometedoras, pero aún no se dispone de suficiente evidencia o de valores de referencia para recomendar su uso: hepcidina en orina, protoporfirina zinc medida en el labio (36) o ferritina en saliva (37).
6.-¿El tratamiento de la ferropenia en niños menores de cinco años mejora su crecimiento y su desarrollo psicomotor? ¿disminuye la mortalidad?
Aunque sabemos que el tratamiento con hierro en niños pequeños mejora los niveles corporales del mismo, sería importante conocer si dicha suplementación tiene efectos a medio o largo plazo en resultados de salud, tanto en crecimiento somático como en neurodesarrollo.
En consonancia con las funciones conocidas del hierro, el estudio electrofisiológico de lactantes de seis meses ferropénicos evidencia retrasos madurativos del sistema nervioso: mielinización, crecimiento dendrítico, y neurotransmisores (dopamina, serotonina y neuro epinefrina), con lo que ello puede suponer para los distintos dominios del desarrollo funcional (38). Los lactantes con ferropenia de entre 6 y 24 meses de edad, están en riesgo de peores resultados cognitivos, motores y socioemocionales (39). Parece haber una relación no lineal (p=0,02) entre niveles de ferritina y resultados en inventarios de desarrollo, según muestra un estudio de cohortes en niños de entre 1 y 3 años (32). Estudios observacionales retrospectivos dan cuenta de peores resultados académicos y emocionales a los 25 años en el grupo que había padecido ferropenia crónica en la lactancia (40). Pero, ¿sabemos si los resultados habrían sido diferentes de haber sido tratados con hierro?
Dado que el desarrollo es un proceso dinámico, el posible efecto del déficit férrico dependería en gran medida del momento del inicio del déficit, de la intensidad del mismo, de la existencia de factores biológicos concomitantes con efectos sobre el neurodesarrollo, de la carga genética y de los factores ambientales, entre otros. De ahí la dificultad de encontrar resultados con suficiente evidencia de una relación causa-efecto. Con el objetivo de examinar la influencia individual y conjunta sobre el funcionamiento neurocognitivo de los adolescentes de factores como ferropenia, suplementación con hierro y estrés familiar en la lactancia, y estrés en la adolescencia, se llevó a cabo un estudio de cohortes con adolescentes de nivel socioeconómico medio bajo en Chile; previamente habían formado parte de un ensayo clínico de suplementación férrica. Los autores llegan a la conclusión de que todos los factores estudiados tienen efecto sobre distintos aspectos conductuales posteriores, poniendo énfasis en la importancia de los factores estresantes. En cuanto a desarrollo motor, los adolescentes que habían sido suplementados tenían mejores parámetros si previamente eran deficitarios de hierro, y no si tenían niveles normales; entre los no suplementados, la valoración de la función motora fue mejor en los que tenían niveles adecuados de hierro durante la lactancia (41).
Un estudio realizado en Turquía (42) mostró diferencias en desarrollo motor y cognitivo entre lactantes ferropénicos, anémicos y controles; tras tres meses de tratamiento, las diferencias fueron menores: el componente motor mejoró en los anémicos, y el cognitivo tanto en los anémicos como en los ferropénicos. Los grupos no eran equiparables (mayores tasas de lactancia materna y nivel educativo en el grupo control) y sobre todo no se comparó con placebo, con cegamiento simple.
En 2013 se llevó a cabo una revisión Cochrane con objeto de conocer los efectos de la terapia con hierro sobre el desarrollo motor y la función cognitiva en menores de 3 años con anemia ferropénica (43). Los ensayos que valoraron la evolución dentro de los 30 días tras el tratamiento no demostraron cambios en el componente motor (la diferencia en el índice de desarrollo psicomotor [IDP] de la escala de Bayley entre los grupos de hierro y placebo fue -1,25 (IC 95 %: -4,56 a 2,06; p = 0,65) ni en la maduración cognitiva (el índice de desarrollo mental (IDM) de la escala de Bayley fue 1,04 (IC 95%: -1,30 a 3,39; p = 0,79)). En cuanto a los estudios que evaluaron después de 30 días de terapia, uno de ellos a los dos meses informó de una diferencia de 0,8 en la escala de Denver (IC del 95%: -0,18 a 1,78; p = 0,11), mientras que el otro estudio mostró diferencias entre el grupo de intervención y el grupo placebo después de cuatro meses de tratamiento en la escala de Bayley : las diferencias en el IDP fue de 18,40 (IC 95%: 10,16 a 26,64; p < 0,0001; evidencia de calidad moderada), y en el MDI de 18,80 (IC 95%: 10,17 a 27,43; p < 0,0001; evidencia de calidad moderada). Los autores concluyen que no encontraron pruebas de que la terapia con hierro en niños pequeños con anemia ferropénica tuviese efecto en el desarrollo motor o cognitivo medido en el primer mes tras la terapia, que los efectos a largo plazo no son concluyentes, precisándose estudios de seguimiento.
La US Preventive Services Task Force (USPSTF) publicó en 2015 (44) una revisión sobre efectividad y daños de la suplementación y cribado de ferropenia en niños entre 6 y 24 meses en países desarrollados, sin encontrar estudios que evaluaran los beneficios del cribado ya que no daban respuesta a la correlación entre mejoría del nivel férrico tras la terapia y mejoría en crecimiento o neurodesarrollo. No recomendaban por tanto el cribado universal, si bien dejaban aparte la consideración en niños con factores de riesgo o con síntomas (45).
Con objeto de valorar el efecto de suplementos de hierro en población con alta prevalencia de anemia sobre el desarrollo cognitivo, se llevó a cabo un estudio a gran escala de Bangladesh, publicado recientemente. Se reclutaron 3300 lactantes con asignación aleatoria a tres grupos (suplementos hierro, suplementos micronutrientes y placebo) que recibieron régimen terapéutico durante tres meses. No se observaron diferencias en cuanto a crecimiento o neurodesarrollo tras la pauta recibida ni a los 9 meses de concluida ésta (46): diferencia de medias en domino cognitivo respecto al nivel previo: -0,3 puntos (IC 95%, -0,55 a 0,48). El análisis de subgrupos mostró mejoría de los parámetros hematológicos en los que partían de ferropenia con/ sin anemia en el grupo de intervención, pero no se encontraron diferencias en peso, talla ni escalas de neurodesarrollo. En cuanto a efectos secundarios, no encontraron diferencias significativas entre los grupos.
No disponemos por tanto de pruebas que demuestren que el tratamiento con hierro en lactantes con/ sin ferropenia o con/sin anemia suponga mejoría a medio plazo del crecimiento ni del neurodesarrollo.
Un estudio recientemente publicado (47), que valora capacidad proactiva y reactiva en adolescentes mediante neuroimagen, detectó diferencias entre los que tuvieron ferropenia en época fetal, durante la lactancia y un grupo control sin ferropenia, y concluye que a pesar del tratamiento con hierro (que recibieron los que tenían anemia a los 9 meses) las diferencias en la actividad cerebral persisten, y son diferentes según el período afecto. Con lo cual, la medida más eficaz sería la prevención de la deficiencia en las etapas precoces del neurodesarrollo, ya que el tratamiento posterior de la deficiencia por sí solo no parece revertir el efecto deletéreo sobre el desarrollo cerebral.
¿Hay beneficios de cribado universal sobre cribado selectivo?
No se encontraron estudios prospectivos que compararan resultados en salud entre población con cribado universal y cribado selectivo dirigido a grupos de riesgo de ferropenia.
En Canadá se llevó a cabo un estudio de coste utilidad comparando el cribado universal frente a cribado selectivo en población de riesgo mediante la medición de ferritina en lactantes de 18 meses durante la visita de salud (48). Usan un modelo teórico de decisiones a partir de prevalencias, costes estimados y años de vida ajustados por calidad, concluyendo que el incremento de costes que supondría el cribado universal podría ser efectivo sobre no cribar o hacer un cribado dirigido. Parten del concepto de que el tratamiento con hierro mejoraría los resultados neurológicos a largo plazo, hecho del que no disponemos de evidencia; y en población de riesgo solo incluyen lactancias maternas prolongadas no complementadas, obesidad e ingesta de más de 500 ml de leche de vaca al día (consideran de riesgo la coexistencia de al menos dos factores). Aun así, calculan que el 35,5% de la población general estaría en riesgo. Pero excluyen factores de riesgo de ferropenia importantes como las anemias gestacionales graves(49) los crecimientos intrauterinos retardados (10%), los prematuros (INE España 2021 6,67% del total de partos; menos de 32 semanas 1-2 % del total de nacimientos) hemorragias neonatales, consumo de leche de vaca en menores de 12m, y la patología malabsortiva. De haber sido incluidos, puede que el resultado final hubiera sido diferente.
En un estudio de seguimiento (50) para valorar asociación entre nivel de ferritina en cordón al nacimiento y desarrollo conductual y cognitivo a los 2 y 5 años, solo encontraron diferencias al analizar el subgrupo considerado de riesgo (madres fumadoras, obesas y pequeños para la edad gestacional), encontrando que en dicho subgrupo los niños ferropénicos tuvieron mayores problemas de internalización y conductuales.
Recomendaciones prácticas en consulta
Se mantiene la recomendación de la lactancia materna como la mejor manera de proporcionar entre otros beneficios el hierro necesario al lactante. En caso de fórmula artificial, deberán ser fortificadas aun cuando los niveles aconsejables en las fórmulas de continuación no están claros, y son divergentes entre distintos grupos de expertos (51, 52). El Reglamento Europeo 2016/127, de 25 de septiembre de 2015 por el que se regulan los requisitos específicos de composición y de información de los preparados de inicio y de continuación (53) recomienda 0,3-1,3 mg/100kcal (2,1-9,1 mg/l) en las fórmulas de inicio y 0,6-2 mg/100Kcal (3,6 a 14 mg/l) en las de continuación.
En el lactante de más de seis meses especial atención a retrasos en la introducción de la alimentación complementaria rica en hierro. En el mayor de 12 meses la ingesta de lácteos superior a 500ml/ día es riesgo de ferropenia (si la ingesta supera los 600, incrementaría el riesgo no solo de ferropenia, sino de anemia) (52).
Tabla 1.-Factores de riesgo de ferropenia
El mejor parámetro del que disponemos para conocer los depósitos corporales de hierro es la ferritina. Los niveles protectores del desarrollo cerebral no quedan claros al ser los resultados de los distintos estudios inconsistentes. Dicha inconsistencia determina que la calidad de la evidencia sobre los puntos de corte de los niveles de ferritina sea BAJA.
No disponemos de pruebas concluyentes de que la terapia con hierro mejore el desarrollo cognitivo de los niños: hay inconsistencia en los resultados de los distintos estudios, e incluso incertidumbre, al estar referidos a distintos grupos etarios y distintos dominios del neurodesarrollo. BAJA evidencia del efecto del tratamiento con hierro sobre el desarrollo neurológico.
Habida cuenta que los factores de riesgo de ferropenia son conocidos, parece razonable cribar a dicha población, con el objetivo de al menos mejorar sus depósitos férricos, aunque no tengamos pruebas de que podamos con ello optimizar su neurodesarrollo. Los beneficios superarían a los riesgos.
US Preventive Services Task Force (USPSTF)(54)
No encuentran evidencia suficiente para recomendar el cribado universal en los niños sanos.
UK National Screening Committe
Se mantienen en su recomendación de no hacer cribado universal (55), e incluso emiten un comunicado en el que refieren que no hay documentos que por el momento justifiquen una nueva revisión.
American Academy of Pediatrics (AAP) (56)
Recomiendan cribado universal de anemia (Hb) a los 12 meses y valoración de factores de riesgo de ferropenia
1. Se sugiere no hacer cribado universal de ferropenia en menores de cinco años
Calidad de evidencia: baja
Fuerza de la recomendación: débil en contra
2. Se sugiere hacer cribado de ferropenia en los niños de menos de cinco años con factores de riesgo
Calidad de evidencia: baja
Fuerza de la recomendación: débil a favor
Bases de datos:
Pubmed/Medline
Embase
Scopus
Websos Science
Bibliotecas:
Cochrane Library, UpToDate
Estrategia de búsqueda en Pubmed/Medline:
1- Iron deficiency AND screening AND infant, filters 2012-2024
(("iron deficiencies"[MeSH Terms] OR ("iron"[All Fields] AND "deficiencies"[All Fields]) OR "iron deficiencies"[All Fields] OR ("iron"[All Fields] AND "deficiency"[All Fields]) OR "iron deficiency"[All Fields]) AND ("diagnosis"[MeSH Subheading] OR "diagnosis"[All Fields] OR "screening"[All Fields] OR "mass screening"[MeSH Terms] OR ("mass"[All Fields] AND "screening"[All Fields]) OR "mass screening"[All Fields] OR "early detection of cancer"[MeSH Terms] OR ("early"[All Fields] AND "detection"[All Fields] AND "cancer"[All Fields]) OR "early detection of cancer"[All Fields] OR "screen"[All Fields] OR "screenings"[All Fields] OR "screened"[All Fields] OR "screens"[All Fields]) AND ("infant"[MeSH Terms] OR "infant"[All Fields] OR "infants"[All Fields] OR "infant s"[All Fields])) AND (2012:2024[pdat])
2- Iron deficiency AND neurodevelopment, filters 2012-2024
(("iron deficiencies"[MeSH Terms] OR ("iron"[All Fields] AND "deficiencies"[All Fields]) OR "iron deficiencies"[All Fields] OR ("iron"[All Fields] AND "deficiency"[All Fields]) OR "iron deficiency"[All Fields]) AND "neurodevelopment"[All Fields]) AND (2012:2024[pdat])
- World Health Organization. WHO GUIDELINE ON USE OF FERRITIN CONCENTRATIONS TO ASSESS IRON STATUS IN INDIVIDUALS AND POPULATIONS. Geneve; 2020.
- Eussen S, Alles M, Uijterschout L, Brus F, Van Der Horst-Graat J. Iron intake and status of children aged 6-36 months in Europe: A systematic review. Ann Nutr Metab. 2015;66:80–92.
- López-Ruzafa E, Vázquez-López MA, Galera-Martínez R, Lendínez-Molinos F, Gómez-Bueno S, Martín-González M. Prevalence and associated factors of iron deficiency in Spanish children aged 1 to 11 years. Eur J Pediatr. 2021;180(9):2773–80.
- Gedfie S, Getawa S, Melku M. Prevalence and Associated Factors of Iron Deficiency and Iron Deficiency Anemia Among Under-5 Children: A Systematic Review and Meta-Analysis. Vol. 9, Global Pediatric Health. SAGE Publications Inc.; 2022.
- Georgieff MK. The importance of iron deficiency in pregnancy on fetal, neonatal, and infant neurodevelopmental outcomes. International Journal of Gynecology and Obstetrics. 2023;162(S2):83–8.
- Aksu T, Ünal S. Iron deficiency Anemia in Infancy, CHildhood and Adolescence. Turkish Archives Pediatrics. 2023;358–62.
- Georgieff MK, Michael Georgieff CK. The importance of iron deficiency in pregnancy on fetal, neonatal, and infant neurodevelopmental outcomes. Int J Gynecol Obstet. 2023;162 Suppl:83–8.
- Beltrán-Navarro B, Matute E, Vásquez-Garibay EM. Efecto de la deficiencia de hierro sobre el desarrollo neuropsicológico en lactantes Effect of iron deficiency on neuropsychological development in infants. Vol. 36, INTERDISCIPLINARIA. 2019.
- Sundararajan S, Rabe H. Prevention of iron deficiency anemia in infants and toddlers. Pediatric Research. 2021;89:63–73.
- Georgieff MK, Krebs NF, Cusick SE. The Benefits and Risks of Iron Supplementation in Pregnancy and Childhood. Annu Rev Nutr. 2019;39:121–46.
- Jayasinghe C, Polson R, van Woerden HC, Wilson P. The effect of universal maternal antenatal iron supplementation on neurodevelopment in offspring: A systematic review and meta-analysis. BMC Pediatr. 2018;18:150.
- Iglesias L, Canals J, Arija V. Effects of prenatal iron status on child neurodevelopment and behavior: A systematic review. Crit Rev Food Sci Nutr. 2018;58(10):1604–14.
- Singh L, Singh D, Deepika, Raghunandan C, Dhoat N. A clinical study of fetal outcome following early and delayed cord clamping in births associated with anemia in pregnancy. J Family Med Prim Care. 2022;11(5):1789.
- Andersson O, Lindquist B, Lindgren M, Stjernqvist K, Domellöf M, Hellström-Westas L. Effect of delayed cord clamping on neurodevelopment at 4 years of age: A randomized clinical trial. JAMA Pediatr. 2015;169(7):631–8.
- Rabe H, Mercer J, Erickson-Owens D. What does the evidence tell us? Revisiting optimal cord management at the time of birth. Vol. 181, European Journal of Pediatrics. Eur J Pediatr. 2022;181:1797–807.
- Cusick SE, Georgieff MK, Rao R. Approaches for reducing the risk of early-life iron deficiency-induced brain dysfunction in children. Vol. 10, Nutrients. 2018;10:227.
- Sánchez Ruiz-Cabello Grupo PrevInfad FJ, Soriano Faura FJ, Colomer Revuelta J, Cortés Rico O, Esparza Olcina MJ, Galbe Sánchez-Ventura J, et al. Grupo PrevInfad/PAPPS Infancia y Adolescencia Prevención y cribado de la ferropenia en lactantes. Rev Pediatr Aten Prim. 2012;14:75–82.
- Victora CG, Lessa Horta B, Loret De Mola C, Quevedo L, Tavares Pinheiro R, Gigante DP, et al. Association between breastfeeding and intelligence, educational attainment, and income at 30 years of age: a prospective birth cohort study from Brazil. Lancet Glob Health. 2015;3:e199-205.
- Moreno-Fernandez J, Ochoa JJ, Latunde-Dada GO, Diaz-Castro J. Iron deficiency and iron homeostasis in low birth weight preterm infants: A systematic review. Nutrients. 2019;11:1090.
- McCarthy EK, Dempsey EM, Kiely ME. Iron supplementation in preterm and low-birth-weight infants: A systematic review of intervention studies. Nutr Rev. 2019;77:865–77.
- Powers JM, Buchanan GR. Effect of low dosis ferrous sulfate vs iron polysaccharide in young children with nutritional iron deciciency Anemia. JAMA. 2017;317:2297-304.
- Mattiello V, Schmugge M, Hengartner H, von der Weid N, Renella R. Diagnosis and management of iron deficiency in children with or without anemia: consensus recommendations of the SPOG Pediatric Hematology Working Group. Eur J Pediatr. 2020;179:527–45.
- Neef V, Schmitt E, Bader P, Zierfuß F, Hintereder G, Steinbicker AU, et al. The reticulocyte hemoglobin equivalent as a screening marker for iron deficiency and iron deficiency anemia in children. J Clin Med. 2021;10:3506.
- Chandra J, Dewan P, Kumar P, Mahajan A, Singh P, Dhingra B, et al. Diagnosis, treatment and prevention nutritional anemia in children: Recommendations of the Joint Committee of Pediatric Hematology-Oncology Chapter and Pediatric and Adolescent Nutrition Society of the Indian Academy of Pediatrics. Indian Pediatr. 2022;59:782-801
- Sermini CG, Acevedo MJ, Arredondo M. Biomarkers of metabolism and iron nutrition. Rev Peru Med Exp Salud Publica. 2017;34(4):690–8.
- Moscheo C, Licciardello M, Samperi P, La Spina M, Di Cataldo A, Russo G. New Insights into Iron Deficiency Anemia in Children: A Practical Review. Metabolites. 2022;12:289.
- Yu KH. Effectiveness of zinc protoporphyrin/heme ratio for screening iron deficiency in preschool-aged children. Nutr Res Pract. 2011;5(1):40–5.
- Kanuri G, Chichula D, Sawhney R, Kuriakose K, De’Souza S, Pais F, et al. Optimizing diagnostic biomarkers of iron deficiency anemia in community-dwelling indian women and preschool children. Haematologica. 2018;103(12):1991–6.
- El Gendy FM, El-Hawy MA, Shehata AMF, Osheba HE. Erythroferrone and iron status parameters levels in pediatric patients with iron deficiency anemia. Eur J Haematol. 2018;100(4):356–60.
- Garcia-Casal MN, Pasricha SR, Martinez RX, Lopez-Perez L, Peña-Rosas JP. Serum or plasma ferritin concentration as an index of iron deficiency and overload. Cochrane Database of Systematic Reviews. 2021;5:CD011817.
- Mei Z, Addo OY, Jefferds ME, Sharma AJ, Flores-Ayala RC, Brittenham GM. Physiologically based serum ferritin thresholds for iron deficiency in children and non-pregnant women: a US National Health and Nutrition Examination Surveys (NHANES) serial cross-sectional study. Lancet Haematol. 2021;8(8):e572–82.
- Parkin PC, Koroshegyi C, Mamak E, Borkhoff CM, Birken CS, Maguire JL, et al. Association between Serum Ferritin and Cognitive Function in Early Childhood. Journal of Pediatrics. 2020;217:189-191.e2.
- Mukhtarova N, Ha B, Diamond CA, Plumb AJ, Kling PJ. Serum Ferritin Threshold for Iron Deficiency Screening in One-Year-Old Children. Journal of Pediatrics. 2022;245:217–21.
- Fletcher A, Forbes A, Svenson N, Wayne Thomas D. Guideline for the laboratory diagnosis of iron deficiency in adults (excluding pregnancy) and children. Br J Haematol. 2022;196(3):523–9.
- Jullien S. Screening of iron deficiency anaemia in early childhood. BMC Pediatr. 2021;21(Suppl 1):1–6.
- Hennig G, Homann C, Teksan I, Hasbargen U, Hasmüller S, Holdt LM, et al. Non-invasive detection of iron deficiency by fluorescence measurement of erythrocyte zinc protoporphyrin in the lip. Nat Commun. 2016;7:10776.
- Oshin O, Kireev D, Hlukhova H, Idachaba F, Akinwande D, Atayero A. Graphene-based biosensor for early detection of iron deficiency. Sensors (Switzerland). 2020;20(13):1–13.
- Georgieff MK. Iron assessment to protect the developing brain. Am J Clin Nutr. 2017;106(Suppl 6):1588S–93S.
- Lozoff B. Iron deficiency and child development. Vol. 28, Food and Nutrition Bulletin. 2007.
- Lozoff B, Smith JB, Kaciroti N, Clark KM, Guevara S, Jimenez E. Functional significance of early-life iron deficiency: Outcomes at 25 years. Journal of Pediatrics. 2013;163(5):1260–6.
- Doom JR, Gahagan S, Caballero G, Encina P, Lozoff B. Infant iron deficiency, iron supplementation, and psychosocial stress as predictors of neurocognitive development in Chilean adolescents. Nutr Neurosci. 2021;24(7):520–9.
- Akman M, Cebeci D, Okur V, Angin H, Abali O, Akman AC. The effects of iron deficiency on infants’ developmental test performance. Acta Paediatr. 2004;93:1391–6.
- Wang B, Zhan S, Gong T, Lee L. Iron therapy for improving psychomotor development and cognitive function in children under the age of three with iron deficiency anaemia. Cochrane Database of Systematic Reviews. 2013;2013(6):CD001444.
- McDonagh MS, Blazina I, Dana T, Cantor A, Bougatsos C. Screening and routine supplementation for iron deficiency anemia: A systematic review. Pediatrics. 2015;135:723–33.
- Kemper AR, Fan T, Grossman DC, Phipps MG. Gaps in evidence regarding iron deficiency anemia in pregnant women and young children: summary of US Preventive Services Task Force recommendations. Am J Clin Nutr. 2017;106(Suppl 6):1555–8.
- Pasricha SR, Hasan MI, Braat S, Larson LM, Tipu SMMU, Hossain SJ, et al. Benefits and Risks of Iron Interventions in Infants in Rural Bangladesh. New England Journal of Medicine. 2021;385(11):982–95.
- Hua M, Shi D, Xu W, Zhu L, Hao X, Zhu B, et al. Differentiation between fetal and postnatal iron deficiency in altering brain substrates of cognitive control in pre-adolescence. BMC Med. 2023;21:167.
- Carsley S, Fu R, Borkhoff CM, Reid N, Baginska E, Birken CS, et al. Iron deficiency screening for children at 18 months: a cost-utility analysis. CMAJ Open. 20191;7(4):E689–98.
- Gedfie S, Getawa S, Melku M. Prevalence and Associated Factors of Iron Deficiency and Iron Deficiency Anemia Among Under-5 Children: A Systematic Review and Meta-Analysis. Glob Pediatr Health. 2022;9:2333794X221110860.
- McCarthy EK, Murray DM, Hourihane JOB, Kenny LC, Irvine AD, Kiely ME. Behavioral consequences at 5 y of neonatal iron deficiency in a low-risk maternal-infant cohort. Am J Clin Nutr. 2021;113:1032–41.
- Koletzko B, Bhutta ZA. Compositional requeriments of follow-up formula for use in infancy: recommendations of an international expert group coordinated by the early nutrition academy. Ann Nutr Metab. 2013;62:44–54.
- ESPGHAN. Iron Requeriments of Infants and Toddlers. 2014.
- REGLAMENTO DELEGADO (UE) 2016/ 127 DE LA COMISIÓN - de 25 de septiembre de 2015 - que complementa el Reglamento (UE) no609/ 2013 del Parlamento Europeo y del Consejo en lo que respecta a los requisitos específicos de composición e información aplicables a los preparados para lactantes y preparados de continuación, así como a los requisitos de información sobre los alimentos destinados a los lactantes y niños de corta edad.
- McDonagh MS, Blazina I, Dana T, Cantor A, Bougatsos C. Screening and routine supplementation for iron deficiency anemia: A systematic review. Pediatrics. 2015;135:723–33.
- Screening for iron deficiency anaemia in children under 5 years External review against programme appraisal criteria for the UK National Screening Committee [Internet]. 2017. Available from: www.gov.uk/uknsc
- Baker RD, Greer FR, Bhatia JJS, Abrams SA, Daniels SR, Schneider MB, et al. Clinical report - Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and young children (0-3 years of age). Pediatrics. 2010;126(5):1040–50.